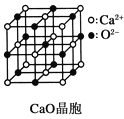
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 等物质的量的NaN3和Na2O2中所含阴离子数为3:2
B. 1L CO的质量一定比1L O2的质量小
C. 标准状况下,将3.36 L Cl2通入1 L0.2 mol/L FeBr2溶液中,被氧化的Br数目为0.1NA
D. 标准状况下,11 g由3H和16O组成的超重水中,中子数和电子数之和为10NA
【答案】C
【解析】A、等物质的量的NaN3和Na2O2中所含阴离子N3-与O22-的个数比为1:1,选项A错误;B、氧气的摩尔质量大,但CO与氧气所处的状态下的气体摩尔体积不一定相同,故1LCO与1L氮气的物质的量不一定相等,则二者质量不能确定,选项B错误;C、标准状况下,将3.36 L Cl2为0.15mol,通入1 L0.2 mol/L FeBr2溶液中,先氧化0.2mol亚铁离子,消耗0.1mol氯气,剩余0.5mol氧气将0.1molBr-氧化,则被氧化的Br-为0.1NA,选项C正确;D、标准状况下,11 g由3H和16O组成的超重水物质的量为![]() =0.5mol,中子数和电子数之和为[(2×2+8)+(1×2+8)]×0.5NA =11NA,选项D错误。答案选C。
=0.5mol,中子数和电子数之和为[(2×2+8)+(1×2+8)]×0.5NA =11NA,选项D错误。答案选C。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。

①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:

①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。