题目内容
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为___________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为_______________。
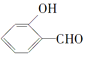 的沸点比
的沸点比![]() 高,原因是______________________。
高,原因是______________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为________________。
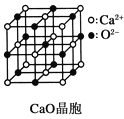
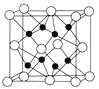
(4)CaF2离子晶体的晶胞结构如图所示。该离子化合物晶胞的边长为a cm,则晶体的密度是_____________g/cm3(只要求列出算式)。
【答案】 2 O—H键、氢键、范德华力 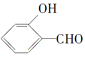 形成分子内氢键,而
形成分子内氢键,而![]() 形成分子间氢键,分子间氢键使分子间作用力增大 sp3 H2O中O原子有2对孤对电子,H3O+中O原子只有1对孤对电子,排斥力较小
形成分子间氢键,分子间氢键使分子间作用力增大 sp3 H2O中O原子有2对孤对电子,H3O+中O原子只有1对孤对电子,排斥力较小 ![]()
【解析】(1)氧元素是8号元素,基态原子的电子排布式为1s22s22p4,核外未成对电子数为2个,故答案为:2;
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键,故答案为:O-H键、氢键、范德华力;低;邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛形成分子间氢键,分子间氢键使分子间作用力增大
(3)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小;
(4)该晶胞中钙原子个数=8×![]() +6×
+6×![]() =4,氧原子个数=8,1mol晶胞的质量为4×78g,1mol晶胞的体积为NA×a3cm3,则该晶体的密度为÷4×78g NA×a3cm3=
=4,氧原子个数=8,1mol晶胞的质量为4×78g,1mol晶胞的体积为NA×a3cm3,则该晶体的密度为÷4×78g NA×a3cm3=![]() ,故答案为:
,故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案