题目内容
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
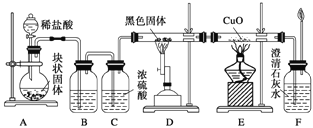
(1)写出装置A中发生反应的化学反应方程式:_______________________。
(2)装置B中最适宜的试剂是:_________________________。
(3)装置D中黑色固体为_____________(填名称),反应的化学方程式为:_____________________________。
(4)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是: ___________________________________。
(5)按照如图装置进行实验时,首先进行的操作名称是_____________。
(6)根据实验中的_________________现象,可证明CO具有还原性,有关反应的化学方程式是___________________________。
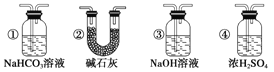
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的___________装置(填序号)。
【答案】CaCO3+2HCl===CaCl2+H2O+CO2↑ 饱和NaHCO3 炭 C+CO2 ![]() 2CO 气体未经干燥进入硬质玻璃管,易使硬质玻璃管炸裂 检查装置的气密性 E装置中黑色固体变成红色 CuO+CO
2CO 气体未经干燥进入硬质玻璃管,易使硬质玻璃管炸裂 检查装置的气密性 E装置中黑色固体变成红色 CuO+CO ![]() Cu+CO2 D E ②
Cu+CO2 D E ②
【解析】
(1)该实验的原理是用盐酸和石灰石制取二氧化碳,盐酸挥发,所以制取的二氧化碳中含有氯化氢气体,除去二氧化碳中的氯化氢气体,用浓硫酸干燥二氧化碳;用干燥的二氧化碳和炭粉反应生成一氧化碳气体,除去二氧化碳后,用纯净的一氧化碳与氧化铜反应,若有二氧化碳生成,则证明一氧化碳具有还原性,最后用燃烧的方法进行尾气处理。
(1)装置A中碳酸钙与盐酸反应生成氯化钙、二氧化碳、水,发生反应的方程式是CaCO3+2HCl===CaCl2+H2O+CO2↑。
(2)实验室用盐酸和石灰石制取二氧化碳,盐酸易挥发,制取的二氧化碳中含有氯化氢气体,为除去氯化氢气体,选取的试剂应能除去氯化氢气体且不和二氧化碳反应,则只能选取可溶性的饱和碳酸氢盐,一般常用饱和的碳酸氢钠溶液,装置B中最适宜的试剂是饱和NaHCO3。
(3)根据实验目的,用D装置制备一氧化碳,高温条件下,二氧化碳和炭反应生成一氧化碳,所以D中的黑色固体是炭,反应方程式为:CO2+C![]() 2CO。
2CO。
(4)若实验中没有装置C,使装置B与装置D直接相连,气体未经干燥进入硬质玻璃管,易使硬质玻璃管炸裂。
(5)气体制备与性质检验的实验,首先进行的操作名称是检验装置的气密性。
(6)一氧化碳具有还原性,所以能还原黑色的氧化铜,使其变为红色的铜单质,所以E中的现象是:黑色固体变为红色,反应方程式为:CO+CuO![]() Cu+CO2。
Cu+CO2。
(7)炭粉和二氧化碳的反应中,二氧化碳不可能完全转化为一氧化碳,所以从D装置出来的气体中含有二氧化碳,为防止原来二氧化碳的干扰,应先把D出来的二氧化碳除去,再将一氧化碳气体通过E装置,二氧化碳是酸性氧化物,所以用碱性物质除去,若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置D与E之间连接下图中的②装置。

 阅读快车系列答案
阅读快车系列答案【题目】W溶液受热会发生分解反应。体积均为2L的4组溶液(忽略反应前后体积的变化),W的物质的量随时间的变化如表,则下列说法不正确的是( )
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A. 在10-20min内,实验①中W的平均分解速率为0.005molL-1min-1
B. a>1.1,且说明浓度越大,反应速率越快
C. 对比①和③,说明温度越高,反应速率越快
D. 对比①和④,不能说明同一时刻W的平均反应速率随温度升高而增大
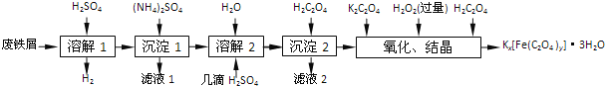
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程。
已知:(NH4)2SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ― |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净。Na2CO3溶液的作用是________。
(2)“溶解1”应保证铁屑稍过量,其目的是___________。“溶解2”加“几滴H2SO4”的作用是________。
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是____________。
(4)“沉淀”时得到的FeC2O4·2H2O沉淀需用水洗涤干净。检验沉淀是否洗涤干净的方法是_______。
(5)“结晶”应将溶液放在黑暗处等待晶体的析出,这样操作的原因是__________。
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤[备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入稀H2SO4酸化,_________,C2O42-转化为CO2被除去。
步骤3:向步骤2所得溶液中______________。
步骤4:用c mol·L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液。