题目内容
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
【答案】(1)CuO+H2SO4=CuSO4+H2O(2分)
(2)Al(OH)3(2分);CuO(2分)
(3)过滤(1分)(4)50(2分)25(2分)
(5)蒸发浓缩、冷却结晶(2分)
【解析】
试题分析:(1)滤渣中含有氧化铜,与稀硫酸反应的方程式为CuO + H2SO4 =CuSO4 + H2O;
(2)CuAlO2中氧为—2价,铝为+3价,则铜为+1价,因此其化学式也可以写为Cu2OAl2O3,相当于氧化亚铜和氧化铝按物质的量之比为1∶1熔合在一起,由此逆推,固体B的主要成分是物质的量之比为1∶1的Al(OH)3和CuO,即固体混合物A的组成为Al(OH)3、CuO;
(3)操作A是分离不溶性固体和液体的方法,属于过滤;
(4)5.0kg=5.0×103g,银铜合金废料中铜的质量为5.0×103g×64%=3200g,铜元素的相对原子质量为64,由m/M=n可求铜的物质的量为3200g÷64g/mol=50mol,根据铜守恒可得转化关系式:Cu~CuAlO2,其中CuAlO2与Cu的物质的量之比等于系数之比,则铜完全转化可以变为50mol CuAlO2;根据铝守恒可得转化关系式:Al2(SO4)3~2CuAlO2,其中Al2(SO4)3与CuAlO2的物质的量之比等于系数之比,则至少需要25mol Al2(SO4)3;由V=n/c可求至少需要硫酸铝溶液的体积为25mol÷1.0mol/L=25L;
(5)胆矾的化学式为CuSO45H2O,是硫酸铜溶液结晶析出的结晶水化合物,根据混合物分离和提纯的方法推断,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤和干燥。

【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,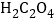 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快