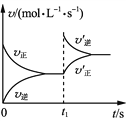
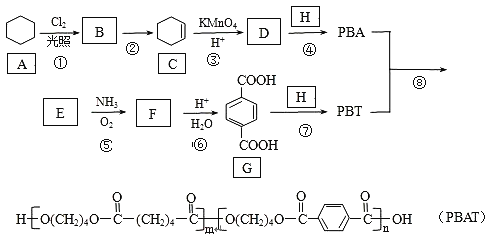
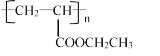题目内容
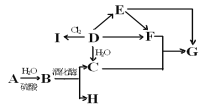
【题目】某兴趣小组以苯胺为原料,按以下反应原理和流程合成对氨基苯磺酸
![]() +H2SO4
+H2SO4 ![]()
![]() +H2O
+H2O
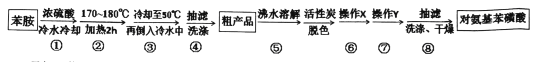
已知:苯胺是一种无色油状液体,微溶于水,易溶于乙醇,熔点-6.1℃,沸点184.4℃。对氨基苯磺酸是一种白色晶体,微溶于冷水,可溶于沸水,易溶于碱性溶液,不溶于乙醇。
(1)下列操作或描述不正确的是________
A.步骤①浓硫酸要分批滴加且不断振荡,并在冰水中冷却目的是为防止苯胺的挥发或碳化
B.步骤③倒入冷水中后,若没有析出晶体,可用玻璃棒搅拌或加入晶种促进晶体析出
C.步骤②加热采用水浴加热,其优点是反应物受热均匀,便于控制温度
D.实验装置中温度计可以改变位置,也可使其水银球浸入在浴液中
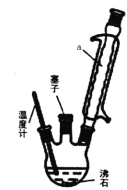
(2)步骤②反应时如图所示装置中进行,其中仪器a的名称_________ 。步骤④中洗涤剂最好选择 ______ 洗涤沉淀的操作是______________。
A. 15%的乙醇 B.热水 C. 冷水 D.NaOH溶液
(3)苯胺与足量浓硫酸反应后,为验证苯胺是否完全反应,可取出几滴反应混合液滴到5-6mL10% NaOH溶液,若 _________现象则认为反应已基本完全。
(4)步骤⑥中操作X为__________,实验有时需要将步骤⑤、⑦、⑧的操作重复多次,其目的是______________________。
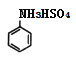
(5)苯胺与浓硫酸混合时会反生副反应产生盐类物质,写出其反应化学方程式____。
(6)步骤⑤至⑧过程 ,下列装置肯定用不到的是___ ,若制得的晶体颗粒较小,分析可能的原因______(写出两点)。
【答案】C 球形冷凝管 A 向过滤器中加入15%的乙醇浸没沉淀,待乙醇自然流出后,重复操作2—3次 得到澄清溶液(或溶液不分层) 趁热过滤 提高对氨基苯磺酸的纯度 H2SO4+![]() →
→ ①⑤ 溶液温度过高或冷却结晶时速度过快
①⑤ 溶液温度过高或冷却结晶时速度过快
【解析】
由实验制备流程可知,为防止与浓硫酸混合时,苯胺挥发或碳化,在冷水冷却的条件下配得浓硫酸苯胺溶液,然后油浴加热到170—180℃,浓硫酸和苯胺反应生成对氨基苯磺酸,待冷却到50℃,将反应混合物倒入冷水中,将所得悬浊液抽滤、洗涤得到粗产品,将粗产品在沸水中溶解,加入活性炭脱色,为防止对氨基苯磺酸冷却时析出,趁热过滤得到滤液,将滤液冷却析出晶体,经抽滤、洗涤、干燥得到对氨基苯磺酸。
(1)A、因浓硫酸具有脱水性,浓硫酸滴入到苯胺中时会放出大量的热,为防止苯胺的挥发或碳化,步骤①浓硫酸要分批滴加且不断振荡,并在冰水中冷却,故正确;
B、步骤③倒入冷水中后,若没有析出晶体,应该用玻璃棒搅拌或加入晶种促进晶体析出,故正确;
C、步骤②中反应温度为170—180℃,高于水的沸点,则加热应采用油浴加热,故错误;
D、温度计的作用是控制反应温度在170—180℃,实验时温度计可以插入反应液中,也可插入油浴中,故正确;
故答案为:C;
(2)仪器a为球形冷凝管,其冷凝回流的作用;因苯胺是一种无色油状液体,微溶于水,易溶于乙醇,对氨基苯磺酸是一种白色晶体,微溶于冷水,可溶于沸水,易溶于碱性溶液,不溶于乙醇,则洗涤时选用15%的乙醇可减少产品的损失,提高产率;洗涤的操作为向过滤器中加入15%的乙醇浸没沉淀,待乙醇自然流出后,重复操作2—3次,故答案为:球形冷凝管;A;向过滤器中加入15%的乙醇浸没沉淀,待乙醇自然流出后,重复操作2—3次;
(3)苯胺是微溶于水的无色油状液体,而对氨基苯磺酸易溶于碱性溶液,若苯胺完全反应,混合液中不存在苯胺,取出几滴反应混合液滴到5-6mL10% NaOH溶液,溶液不分层得到澄清溶液,故答案为:得到澄清溶液(或溶液不分层);
(4)因对氨基苯磺酸可溶于沸水,为防止对氨基苯磺酸冷却时析出,应趁热过滤得到滤液,则步骤⑥为趁热过滤;实验有时需要将步骤⑤、⑦、⑧的操作重复多次,可以有效除去产品中的杂质,提高对氨基苯磺酸的纯度,故答案为:趁热过滤;提高对氨基苯磺酸的纯度;
(5)苯胺含有氨基,可与浓硫酸反应生成盐硫酸氢苯胺,反应的化学方程式为H2SO4+![]() →
→ ,故答案为:H2SO4+
,故答案为:H2SO4+![]() →
→ ;
;
(6)步骤⑤至⑧过程,装置③为沸水溶解,装置④为趁热过滤,装置②为抽滤,整个过程不需要蒸发和灼烧,故选①⑤;因对氨基苯磺酸微溶于冷水,可溶于沸水,若制得的晶体颗粒较小,可能的原因是溶液温度过高或冷却结晶时速度过快,故答案为:①⑤;溶液温度过高;冷却结晶时速度过快。

 口算题卡北京妇女儿童出版社系列答案
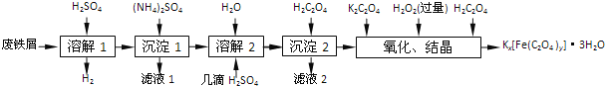
口算题卡北京妇女儿童出版社系列答案【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程。
已知:(NH4)2SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ― |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净。Na2CO3溶液的作用是________。
(2)“溶解1”应保证铁屑稍过量,其目的是___________。“溶解2”加“几滴H2SO4”的作用是________。
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是____________。
(4)“沉淀”时得到的FeC2O4·2H2O沉淀需用水洗涤干净。检验沉淀是否洗涤干净的方法是_______。
(5)“结晶”应将溶液放在黑暗处等待晶体的析出,这样操作的原因是__________。
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤[备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入稀H2SO4酸化,_________,C2O42-转化为CO2被除去。
步骤3:向步骤2所得溶液中______________。
步骤4:用c mol·L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液。