题目内容
17.常温下,下列溶液中各组离子一定大量共存的是( )| A. | 0.1mol•L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- | |
| B. | 中性溶液中:Fe3+、Na+、Br-、SO42- | |
| C. | 在含有苯酚的溶液中:K+、NH4+、Br-、Fe3+ | |
| D. | 澄清透明的溶液中:K+、Al3+、SO42-、MnO4- |
分析 A.醋酸钠能够与氢离子结合生成弱电解质醋酸;
B.铁离子在溶液中水解,溶液显示酸性,不可能为中性;
C.铁离子与苯酚发生显色反应;
D.四种离子之间不反应,且为澄清透明溶液.
解答 解:A.H+与CH3COONa发生反应生成醋酸,在溶液中不能大量共存,故A错误;
B.Fe3+在溶液中部分水解,溶液不可能为中性,故B错误;
C.Fe3+与苯酚发生显色反应,在溶液中不能大量共存,故C错误;
D.K+、Al3+、SO42-、MnO4-之间不发生反应,且为澄清透明溶液,故D正确;
故选D.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
| A. | 滴入KSCN溶液 | B. | 通入氯气 | ||
| C. | 加入氢氧化钠溶液 | D. | 加入铁粉 |
8.已知C(石墨)=C(金刚石),在该反应进程中其能量变化如图所示,有关该反应的描述正确的是( )
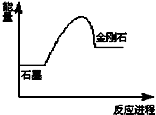

| A. | 该反应为放热反应 | B. | 金刚石比石墨稳定 | ||
| C. | 石墨比金刚石稳定 | D. | 该反应为氧化还原反应 |
5. 下表各组物质中,物质之间不可能实现如图所示转化的是:
下表各组物质中,物质之间不可能实现如图所示转化的是:
( )
 下表各组物质中,物质之间不可能实现如图所示转化的是:
下表各组物质中,物质之间不可能实现如图所示转化的是:| 选项 | X | Y | Z | M |
| A | FeS2 | SO2 | SO3 | O2 |
| B | NaOH | Na2CO3 | NaHCO3 | CO2 |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | AlO2- | Al(OH)3 | Al3+ | NaOH |
| A. | A | B. | B | C. | C | D. | D |
12.小苏打作为食品制作过程中的膨松剂在食品加工产业上有广泛的用途.

(1)某小组拟研究放置己久的小苏打样品中纯碱的质量分数.限选试剂和仪器:NaHCO3样品、碱石灰、0.1mol/LHCl、0.1mol/LH2SO4、浓H2SO4、烧瓶、双孔塞、玻璃导管、胶管、广口瓶、干燥管.
①写出本实验小苏打样品与酸反应的全部化学方程式(两条)2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,Na2CO3+H2SO4=Na2SO4+CO2↑+H2O.
②设计实验方案:实验中除称量样品质量外,还需测定生成CO2的质量.
③设计实验装置,完成下图装置示意图及标注.
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂质量,需记录的待测物理量和所拟定的数据;数据用字母表示).
(2)根据此实验得到的数据,测定结果有误差.因为实验装置还存在一个明显缺陷,该缺陷是需设计一个将A、B中的CO2全部吹入C中的装置.

(1)某小组拟研究放置己久的小苏打样品中纯碱的质量分数.限选试剂和仪器:NaHCO3样品、碱石灰、0.1mol/LHCl、0.1mol/LH2SO4、浓H2SO4、烧瓶、双孔塞、玻璃导管、胶管、广口瓶、干燥管.
①写出本实验小苏打样品与酸反应的全部化学方程式(两条)2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,Na2CO3+H2SO4=Na2SO4+CO2↑+H2O.
②设计实验方案:实验中除称量样品质量外,还需测定生成CO2的质量.
③设计实验装置,完成下图装置示意图及标注.
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂质量,需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 | 样品质量/g | … | ||
| 实 验 | a | … |
2.在一定温度下,向aL恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g).此反应达到平衡的标志是( )
| A. | 容器内X、Y、Z的速率之比为1:2:2 | |
| B. | 单位时间生成0.1 mol X的同时生成0.2 mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | 容器内气体密度不随时间变化 |
9.X、Y、Z、W、R属于短周期主族元素,X是该周期中原子半径最大的元素,Y是地壳中含量最高的元素,Z和W位于同主族,Z的单质常用作半导体材料,R元素的最高正价和最低负价之和为4,下列叙述错误的是( )
| A. | X与Y两元素形成的化合物可能存在共价键 | |
| B. | R的氢化物比Y的氢化物稳定 | |
| C. | Z、W、R最高价氯化物对应水化物的酸性强弱顺序:R>W>Z | |
| D. | Y与R以两种元素组成的常见化合物有2种 |
6.下列说法中正确的是( )
| A. | 40K与40Ca原子中的中子数相等 | |
| B. | 互为同位素的两种核素,它们原子核内的质子数一定相等 | |
| C. | 人们发现了112种元素,即共有112种核素 | |
| D. | 原子结构模型演变历史可以表示为: |
 某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案:
某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案: