题目内容
2.在一定温度下,向aL恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g).此反应达到平衡的标志是( )| A. | 容器内X、Y、Z的速率之比为1:2:2 | |
| B. | 单位时间生成0.1 mol X的同时生成0.2 mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | 容器内气体密度不随时间变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、从反应开始容器内X、Y、Z的速率之比为1:2:2,所以不能作平衡状态的标志,故A错误;
B、单位时间生成0.1 mol X等效于单位时间消耗0.2 mol Z,同时生成0.2 molZ正、逆反应速率相等,达平衡状态,故B正确;
C、当体系达平衡状态时,X、Y、Z的浓度之比可能为1:2:2,也可能不是,与各物质的初始浓度及转化率有关,故C错误;
D、反应体系中各物质都是气体,而且体积不变,所以密度始终不变,不能作平衡状态的标志,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
13.甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
| A. | CH3Cl不存在同分异构体 | B. | CH2Cl2不存在同分异构体 | ||
| C. | CHCl3不存在同分异构体 | D. | CCl4不存在同分异构体 |
17.常温下,下列溶液中各组离子一定大量共存的是( )
| A. | 0.1mol•L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- | |
| B. | 中性溶液中:Fe3+、Na+、Br-、SO42- | |
| C. | 在含有苯酚的溶液中:K+、NH4+、Br-、Fe3+ | |
| D. | 澄清透明的溶液中:K+、Al3+、SO42-、MnO4- |
7.下列有关化学用语表述错误的是( )
| A. |  的系统命名:2-丙醇 的系统命名:2-丙醇 | B. | 明矾的化学式:KAl(SO4)2•12H2O | ||
| C. | CH4Si的结构式: | D. | H2O2的球棍模型: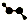 |
14.已知反应X+Y=M+N为吸热反应,对该反应的下列说法中正确的是( )
| A. | X的能量一定低于M的能量 | |
| B. | Y的能量一定低于N的能量 | |
| C. | X和Y的总能量一定低于M和N的总能量 | |
| D. | 因该反应为吸热反应,故该反应一定要加热才可发生 |
11.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
12.某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )


| A. | a和b不连接时,铁片上会有金属铜析出,从而使铁的腐蚀速率加快 | |
| B. | a和b用导线连接时,铜片上发生的反应为Cu2++2e-═Cu | |
| C. | a和b分别连接直流电源正、负极,能实现铁上镀铜,并使Cu2+向铜电极移动 | |
| D. | 无论a和b是否连接,铁片均会溶解 |

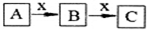 A、B、C、x均为中学化学常见物质,且A、B、C含有同一种元素,在一定条件下发生如图所示的化学变化.则x不可能是( )
A、B、C、x均为中学化学常见物质,且A、B、C含有同一种元素,在一定条件下发生如图所示的化学变化.则x不可能是( )