题目内容
8.已知C(石墨)=C(金刚石),在该反应进程中其能量变化如图所示,有关该反应的描述正确的是( )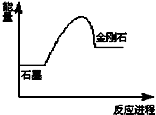
| A. | 该反应为放热反应 | B. | 金刚石比石墨稳定 | ||
| C. | 石墨比金刚石稳定 | D. | 该反应为氧化还原反应 |
分析 由图可知,石墨转化为金刚石需要吸热,能量低的物质稳定,并利用化合价来分析氧化还原反应.
解答 解:A、由图可知,C(石墨)═C(金刚石)△H>0,该反应为吸热反应,故A错误;
B、由图可知,石墨的能量低,石墨稳定,故B错误;
C、由图可知,石墨的能量低,石墨稳定,故C正确;
D、C(石墨)═C(金刚石),碳元素的化合价在反应前后都是0,没有化合价的变化,则不属于氧化还原反应,故D错误;
故选C.
点评 本题考查化学反应中的能量变化及能量变化图,明确物质的稳定性与能量的关系、化合价与氧化还原反应的关系即可解答,难度不大.

练习册系列答案
相关题目
13.C(s)与H2O(g)反应生成1molCO(g)和1molH2(g)吸收131.5kJ热量.该反应的热化学方程式为 ( )
| A. | C+H2O=CO+H2△H=+131.5kJ•mol-1 | |
| B. | C(s)+H2O(g)=CO(g)+H2(g)△H=-131.5KJ/mol | |
| C. | C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5KJ•mol-1. |
16.下列说法中正确的是( )
| A. | 原子及其离子的核外电子层数等于该元素所在周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10列的元素都是金属元素 | |
| C. | 稀有气体原子的最外层电子数都是8个 | |
| D. | 原子的最外层电子数等于该元素所在族序数 |
3.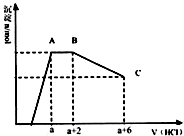 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )| A. | 原溶液肯定含有OH-,CO32-,AlO2-,SiO32- | |
| B. | K+和Na+至少含有其中一种 | |
| C. | n(CO32-):n(AlO2-)=3:2 | |
| D. | a值肯定大于$\frac{4}{3}$ |
13.甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
| A. | CH3Cl不存在同分异构体 | B. | CH2Cl2不存在同分异构体 | ||
| C. | CHCl3不存在同分异构体 | D. | CCl4不存在同分异构体 |
20.下列对事实的解释或由事实所得结论中,正确的是( )
| 事实 | 解释或结论 | |
| A | 常温下铁、铝均不溶于浓硫酸 | 常温下铁、铝与浓硫酸均不反应 |
| B | 测定同浓度的Na2CO3溶液的pH小于Na2SiO3溶液的pH | 非金属性:C<Si |
| C | 向某溶液中加入2滴KSCN浓液、溶液不显红色;再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 用浓、稀硝酸分别完全溶解等质量的铜粉,参加反应的硝酸的物质的量比较:稀硝酸中的<浓硝酸中的 | 稀硝酸氧化性比浓硝酸强 |
| A. | A | B. | B | C. | C | D. | D |
17.常温下,下列溶液中各组离子一定大量共存的是( )
| A. | 0.1mol•L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- | |
| B. | 中性溶液中:Fe3+、Na+、Br-、SO42- | |
| C. | 在含有苯酚的溶液中:K+、NH4+、Br-、Fe3+ | |
| D. | 澄清透明的溶液中:K+、Al3+、SO42-、MnO4- |
18.对于放热反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,下列说法正确的是( )
| A. | 产物H20所具有的总能量高于反应物H2和O2所具有的总能量 | |
| B. | 反应物H2所具有的能量高于产物H2O所具有的总能量 | |
| C. | 反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 | |
| D. | 反应物H2和02具有的能量相等 |
 .
.