题目内容
2.含n g硝酸的稀溶液恰好和m g铁粉完全反应若有$\frac{n}{4}$g HNO3 被还原成NO,n:m可能( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 9:2 |
分析 Fe和稀硝酸反应方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,Fe可能被氧化为铁离子或亚铁离子,结合电子守恒计算.
解答 解:①若Fe被氧化为亚铁离子,由电子守恒可知,$\frac{m}{56}$×(2-0)=$\frac{\frac{n}{4}g}{63g/mol}$×(5-2),解得m:n=3:1,
②若Fe被氧化为铁离子,由电子守恒可知,$\frac{m}{56}$×(3-0)=$\frac{\frac{n}{4}g}{63g/mol}$×(5-2),解得m:n=9:2,
③Fe可能被氧化生成铁离子和亚铁离子,则m:n介于3:1~9:2之间,
故选CD.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
相关题目
12.下列状态的物质,既能导电又属于电解质的( )
| A. | 熔融的KCl | B. | NaCl溶液 | C. | 液态氯化氢 | D. | NaCl晶体 |
13.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
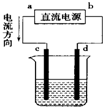

| A. | a为负极,b为正极 | B. | d为阳极,c为阴极 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
10.若7x%和x%的两种液体等体积混合,其质量分数大于4x%,此溶质可能是( )
| A. | H2SO4 | B. | NH3•H2O | C. | NaOH | D. | 乙醇 |
17.下列事实中能说明亚硝酸是弱电解质的是( )
| A. | 用HNO2溶液做导电试验,灯光较暗 | |
| B. | HNO2是共价化合物 | |
| C. | 亚硝酸不与氯化钠反应 | |
| D. | 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
7.下面有关电化学的图示,完全正确的是( )
| A. | 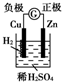 Cu-Zn原电池 | B. | 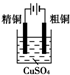 粗铜的精炼 | ||
| C. | 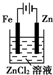 铁片镀锌 | D. | 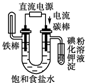 验证NnCl溶液(含酚酞) |
14.某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为:[X2]=0.4mol•L-1,[Y2]=0.8mol•L-1,[Z]=0.4mol•L-1,则该反应的反应式可表示为( )
| A. | X2+2Y2?2XY2 | B. | 2X2+Y2?X2Y | C. | 3X2+Y2?2X3Y | D. | X2+3Y2?2XY3 |
11.下列物质中含原子数最多的是( )
| A. | 6.4g O2 | B. | 8.8g CO2 | C. | 0.1mol N2 | D. | 3.01×1022个H2O |
12.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
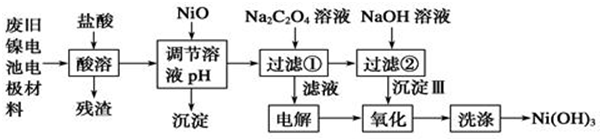
已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.

已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.