题目内容
【题目】![]() 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成
是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成![]() 固体,模拟工业上用过氧化氢法制备
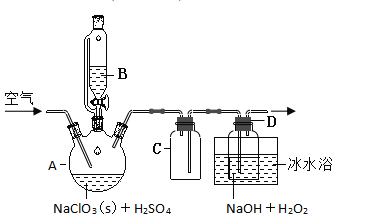
固体,模拟工业上用过氧化氢法制备![]() 固体的实验装置如图所示。
固体的实验装置如图所示。
已知:![]() 熔点-59℃、沸点11℃、
熔点-59℃、沸点11℃、![]() 沸点150℃
沸点150℃
![]() 中的化学方程式:
中的化学方程式:![]()
(1)![]() 放入仪器
放入仪器![]() 中,仪器
中,仪器![]() 中的药品是__________(写化学式)。如果仪器
中的药品是__________(写化学式)。如果仪器![]() 改成分液漏斗,实验过程中可能会出现的实验现象__________。
改成分液漏斗,实验过程中可能会出现的实验现象__________。
(2)![]() 装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
(3)向![]() 装置中通入空气,其作用是赶出
装置中通入空气,其作用是赶出![]() ,然后通过
,然后通过![]() 再到
再到![]() 中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
(4)冰水浴冷却的目的是__________。
a.降低![]() 的溶解度 b.减少
的溶解度 b.减少![]() 的分解 c.使
的分解 c.使![]() 变为液态 d.加快反应速率
变为液态 d.加快反应速率
(5)写出![]() 中发生反应的化学方程式__________,
中发生反应的化学方程式__________,![]() 在反应起到__________作用。假设在反应中消耗掉
在反应起到__________作用。假设在反应中消耗掉![]() 则有__________
则有__________![]() 电子转移。
电子转移。
【答案】H2O2 液体无法顺利滴落 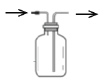 空气流速快时,
空气流速快时,![]() 不能被充分吸收 空气流速过慢时,
不能被充分吸收 空气流速过慢时,![]() 不能及时被移走,浓度过高导致分解 abc 2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O 还原剂 a/17
不能及时被移走,浓度过高导致分解 abc 2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O 还原剂 a/17
【解析】
氯酸钠(NaClO3)在酸性条件下与过氧化氢生二氧化氯,ClO2与氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过冷却结晶,过滤洗涤得到晶体NaClO23H2O。
(1)![]() 放入仪器
放入仪器![]() 中,仪器
中,仪器![]() 中的药品是H2O2,仪器B为滴液漏斗,其目的是平衡气压,使得溶液能够顺利滴入,如果仪器
中的药品是H2O2,仪器B为滴液漏斗,其目的是平衡气压,使得溶液能够顺利滴入,如果仪器![]() 改成分液漏斗,实验过程中可能会出现的实验现象是:分液漏斗中的液体无法顺利滴落,反应无法继续进行;
改成分液漏斗,实验过程中可能会出现的实验现象是:分液漏斗中的液体无法顺利滴落,反应无法继续进行;
(2)实验中C的作用是防止倒吸,![]() 装置中的右侧导管太短,不利于气体的流动,合理的装置图为:
装置中的右侧导管太短,不利于气体的流动,合理的装置图为: ;
;
(3)向![]() 装置中通入空气,其作用是赶出
装置中通入空气,其作用是赶出![]() ,然后通过
,然后通过![]() 再到
再到![]() 中反应。空气流速不能过快,因为空气流速快时,
中反应。空气流速不能过快,因为空气流速快时,![]() 不能被充分吸收;空气流速也不能过慢,空气流速过慢时,
不能被充分吸收;空气流速也不能过慢,空气流速过慢时,![]() 不能及时被移走,浓度过高导致分解;
不能及时被移走,浓度过高导致分解;
(4) NaClO2的溶解度随温度升高而增大,过氧化氢易分解,所以冰水浴冷却的目的是:降低![]() 的溶解度、减少
的溶解度、减少![]() 的分解,由于
的分解,由于![]() 的沸点较低,所以还能使
的沸点较低,所以还能使![]() 变为液态,方便使用;
变为液态,方便使用;
(5)写出![]() 中发生反应的化学方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,
中发生反应的化学方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,![]() 在反应中得电子,起到还原剂的作用。反应中存在关系:
在反应中得电子,起到还原剂的作用。反应中存在关系:![]() ~2e-,若在反应中消耗掉
~2e-,若在反应中消耗掉![]() ,则转移的电子的物质的量为:2×a g/(34g·mol-1)= a/17mol。
,则转移的电子的物质的量为:2×a g/(34g·mol-1)= a/17mol。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案