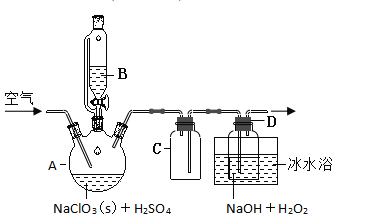
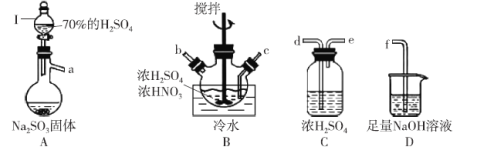
题目内容
【题目】转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
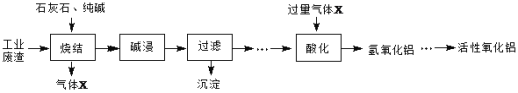
(1)烧结产物主要有NaAlO2、CaSiO3、NaFeO2及气体X。气体X是_________。
(2)烧结产物NaAlO2也可以通过所学知识由Al2O3转化得到,写出反应的离子方程式____
(3)写出由氢氧化铝制备氧化铝的化学方程式:____________________。
(4)碱浸前需将烧结产物进行粉碎,其目的是_________。碱浸过程中,NaFeO2可与水应生成NaOH和一种含铁的化合物,写出该反应的化学方程式_________________。
(5)某同学设计了由废渣(Al2O3、Fe2O3)制备纯净的Al2(SO4)3·18H2O晶体的实验步骤。请利用所学和流程中的信息补充完整:向一定量滤渣中加入足量的稀硫酸,充分反应,无不溶物后,滴加NaOH溶液至生成的沉淀不再减少,过滤,__________,将所得溶液蒸发浓缩,冷却结晶,过滤,抽干,装瓶。(实验中必须使用的试剂:CO2气体、稀硫酸、蒸馏水)
(6)已知试剂EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应。现测定硫酸铝晶体样品中Al2(SO4)3·18H2O(摩尔质量为666g/mol)质量分数的实验步骤如下:(杂质不与EDTA反应)
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却。
步骤3:再向上述溶液中加入c2 mol·L- 1Pb(NO3)2 溶液V2mL 恰好与过量的EDTA溶液完全反应。
请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。__________(写出具体计算过程)
【答案】CO2 Al2O3+2OH-=2AlO2-+H2O 2Al(OH)3![]() Al2O3+ 3H2O 增大接触面积,加快反应速率,提高浸出率 NaFeO2+2 H2O=Fe(OH)3 ↓+NaOH 向滤液中通入足量的二氧化碳气体,至沉淀不再增多,过滤;用蒸馏水洗涤沉淀2-3次;加入稀硫酸至沉淀完全溶解
Al2O3+ 3H2O 增大接触面积,加快反应速率,提高浸出率 NaFeO2+2 H2O=Fe(OH)3 ↓+NaOH 向滤液中通入足量的二氧化碳气体,至沉淀不再增多,过滤;用蒸馏水洗涤沉淀2-3次;加入稀硫酸至沉淀完全溶解 ![]()
【解析】
根据题中对该废渣进行处理来获取活性氧化铝可知,本题考查工业制取Al2O3,运用Al2O3、Fe2O3、SiO2的化学性质及含铝化合物之间的转化分析。
(1)加入石灰石、纯碱烧结,可生成硅酸盐、偏铝酸盐,同时生成二氧化碳气体。
故答案为:CO2;
(2)NaAlO2可由Al2O3与强碱反应制得。因此反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)氢氧化铝受热分解成氧化铝和水,因此由氢氧化铝制备氧化铝的化学方程式为:2Al(OH)3![]() Al2O3+ 3H2O。
Al2O3+ 3H2O。
故答案为:2Al(OH)3![]() Al2O3+ 3H2O;
Al2O3+ 3H2O;
(4) 碱浸前需将烧结产物进行粉碎,可增大反应物接触面积,加快反应速率,提高烧结产物的浸出率,碱浸过程中,NaFeO2可与水反应生成NaOH和一种含铁的化合物,应为Fe(OH)3,因此该方程式为:NaFeO2+ H2O=Fe(OH)3 ↓+NaOH。
故答案为:增大接触面积,加快反应速率,提高浸出率;NaFeO2+2H2O=Fe(OH)3 ↓+NaOH;
(5)当滴加NaOH溶液至生成的沉淀不再减少,过滤后,可向滤液中通入足量的二氧化碳气体,至沉淀不再增多,过滤;用蒸馏水洗涤沉淀2-3次除去杂质;加入稀硫酸至沉淀完全溶解,将所得溶液蒸发浓缩,冷却结晶,过滤,抽干,装瓶即可得到纯净的Al2(SO4)3·18H2O晶体;
故答案为:向滤液中通入足量的二氧化碳气体,至沉淀不再增多,过滤,用蒸馏水洗涤沉淀2-3次,加入稀硫酸至沉淀完全溶解;
(6)EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应,可用如下关系式表示:Pb2+~EDTA、Al3+~EDTA,由此可知该样品中Al2(SO4)3·18H2O的质量分数为![]()
故答案为:![]() 。
。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为__________。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3 mol/L。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________。增加压强,NO的转化率________________(填“提高”“不变”或“降低”)。
②着吸收反应的进行,吸收剂溶液的pH逐渐____________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______________反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是____________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是______________。
②知下列反应:
SO2(g)+2OH-(aq) =SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq)ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=______。
【题目】除去下列物质中的杂质( )![]() 括号内为杂质
括号内为杂质![]() ,所选用的试剂及操作方法均正确的一组是( )
,所选用的试剂及操作方法均正确的一组是( )
选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
A |
| 水 | 溶解、过滤、结晶 |
B |
| 稀盐酸 | 溶解、过滤、洗涤、干燥 |
C |
| 氢氧化钠溶液 | 过滤 |
D |
| 氧气 | 点燃 |
A.AB.BC.CD.D