题目内容
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)![]() 泄漏会导致人体中毒,用于检测
泄漏会导致人体中毒,用于检测![]() 的传感器的工作原理如图所示:
的传感器的工作原理如图所示:

①写出电极Ⅰ上发生的反应式:__________
②工作一段时间后溶液中![]() 的浓度__________(填“变大”、“变小”或“不变”)
的浓度__________(填“变大”、“变小”或“不变”)
(2)用![]() 氧化
氧化![]() 制取
制取![]() ,可提高效益,减少污染。反应为:
,可提高效益,减少污染。反应为:![]() ,通过控制条件,分两步循环进行,可使
,通过控制条件,分两步循环进行,可使![]() 转化率接近100%,其原理如图所示:
转化率接近100%,其原理如图所示:
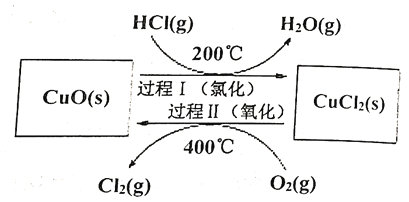
过程Ⅰ的反应为:![]()
过程Ⅱ反应的热化学方程式(![]() 用含有
用含有![]() 和
和![]() 的代数式表示)__________。
的代数式表示)__________。
(3)在温度![]() ,容积为
,容积为![]() 的绝热容器中,充入
的绝热容器中,充入![]() ,发生反应:
,发生反应:![]() ,容器中
,容器中![]() 的相关量随时间变化如图所示。
的相关量随时间变化如图所示。

①反应到![]() 时,
时,![]() 的转化率是__________。
的转化率是__________。
②根据图示,以下各点表示反应达到平衡状态的是________。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
③![]() 内容器中
内容器中![]() 的反应速率增大,而
的反应速率增大,而![]() 后容器中
后容器中![]() 的反应速率减小了,原因是_______。
的反应速率减小了,原因是_______。
④此容器中反应达平衡时,温度若为![]() ,此温度下的平衡常数
,此温度下的平衡常数![]() =__________。
=__________。
(4)工业上可用![]() 溶液吸收法处理
溶液吸收法处理![]() ,25℃时用
,25℃时用![]() 的
的![]() 溶液吸收
溶液吸收![]() ,当溶液
,当溶液![]() 时,溶液中各离子浓度的大小关系为:
时,溶液中各离子浓度的大小关系为:![]() 。(已知25℃时:
。(已知25℃时:![]() 的电离常数
的电离常数![]() ,
,![]() )请结合所学理论通过计算说明
)请结合所学理论通过计算说明![]() 的原因__________。
的原因__________。
【答案】CO-2e-+H2O=CO2+2H+ 不变 O2(g)+2CuCl2(s) ![]() 2Cl2(g)+2CuO(s)
2Cl2(g)+2CuO(s) ![]() 80% d 反应放热,体系的温度升高,反应速率加快,后来NO2的浓度减小,反应速率随之减小 225 根据Ka2= c(SO32-)·c(H+)/ c(HSO3-)= 6.2x10-8,将c(H+)=1.0×10-7代入得出c(SO32-)/ c(HSO3-)= 6.2×10-1<1,所以c(HSO3-)> c(SO32-)
80% d 反应放热,体系的温度升高,反应速率加快,后来NO2的浓度减小,反应速率随之减小 225 根据Ka2= c(SO32-)·c(H+)/ c(HSO3-)= 6.2x10-8,将c(H+)=1.0×10-7代入得出c(SO32-)/ c(HSO3-)= 6.2×10-1<1,所以c(HSO3-)> c(SO32-)
【解析】
(1)由传感器的工作原理图示可知,电极Ⅰ为负极,负极的电极反应式为:CO-2e-+H2O=CO2+2H+,电极Ⅱ为正极,正极的电极反应式为:O2+4H++4e-=2H2O,所以总反应为:2CO+O2=2CO2,所以工作一段时间后硫酸溶液的浓度不变;
(2)根据盖斯定律,过程Ⅱ的热化学方程式=总反应的热化学方程式-过程Ⅰ的热化学方程式×2,总反应的热化学方程式为:![]()
过程Ⅰ的热化学方程式为:![]()
所以过程Ⅱ反应的热化学方程式为:
O2(g)+2CuCl2(s) ![]() 2Cl2(g)+2CuO(s)
2Cl2(g)+2CuO(s) ![]() ;
;
(3) 根据图中![]() 的浓度随时间变化曲线可知,
的浓度随时间变化曲线可知,![]() 的初始浓度为0.20 mol/L,
的初始浓度为0.20 mol/L,![]() 的平衡浓度为0.02 mol/L,从而列出三段式可求出反应的平衡常数,同时也可求出6s时
的平衡浓度为0.02 mol/L,从而列出三段式可求出反应的平衡常数,同时也可求出6s时![]() 的转化率;
的转化率;
(4) 充分利用题中所给的数据,要说明c(HSO3-)> c(SO32-)的原因,初步判断从第二步的电离平衡常数表达式入手,将已知数据代入即可求出。
(1)①电极Ⅰ为负极,负极的电极反应式为:CO-2e-+H2O=CO2+2H+;
②电池总反应为:2CO+O2=2CO2,不消耗水也不消耗硫酸,所以工作一段时间后硫酸溶液的浓度不变;
(2)根据盖斯定律,根据过程Ⅱ的热化学方程式和总反应的热化学方程式可求出过程Ⅱ反应的热化学方程式为:O2(g)+2CuCl2(s) ![]() 2Cl2(g)+2CuO(s)
2Cl2(g)+2CuO(s) ![]() ;
;
(3)①反应到![]() 时,
时,![]() 的浓度为0.04mol/L,其初始浓度为0.2mol/L,则
的浓度为0.04mol/L,其初始浓度为0.2mol/L,则![]() 的转化率为:(0.2-0.04)/0.2×100%=80%;
的转化率为:(0.2-0.04)/0.2×100%=80%;
②根据图示,反应进行到点W时,![]() 的浓度已经不再变化,所以表示反应达到平衡状态的是点W;
的浓度已经不再变化,所以表示反应达到平衡状态的是点W;
③![]() 内容器中
内容器中![]() 的反应速率增大,而
的反应速率增大,而![]() 后容器中
后容器中![]() 的反应速率减小了,原因是:该反应是放热反应,体系的温度升高,反应速率加快,随着反应的进行,NO2的浓度减小,反应速率随之减小;
的反应速率减小了,原因是:该反应是放热反应,体系的温度升高,反应速率加快,随着反应的进行,NO2的浓度减小,反应速率随之减小;
④根据图中![]() 的浓度随时间变化曲线可知,
的浓度随时间变化曲线可知,![]() 的初始浓度为0.20mol/L,W点时反应达到平衡,
的初始浓度为0.20mol/L,W点时反应达到平衡,![]() 的平衡浓度为0.02mol/L,从而列出三段式为:
的平衡浓度为0.02mol/L,从而列出三段式为:

从而可算出温度为![]() 下的平衡常数K=
下的平衡常数K= ![]() ;
;
(4)要证明c(HSO3-)> c(SO32-),根据离子的种类及给出的数据,初步判断从第二步的电离平衡常数的表达式入手,根据Ka2= c(SO32-)·c(H+)/ c(HSO3-)= 6.2![]() 10-8,pH=7,将c(H+)=1.0
10-8,pH=7,将c(H+)=1.0![]() 10-7代入得出c(SO32-)/ c(HSO3-)= 6.2
10-7代入得出c(SO32-)/ c(HSO3-)= 6.2![]() 10-1<1,所以c(HSO3-)> c(SO32-)。
10-1<1,所以c(HSO3-)> c(SO32-)。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案