题目内容
(16分)I、(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA + HB- (少量)=A_ + H2B ,②H2B(少量) + C- = HB_ + HC ,③HA(少量) + C- =A_ + HC 。则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小是:_______
A c(H+) B c(H+)/c(CH3COOH) C c(H+)·c(OH-)
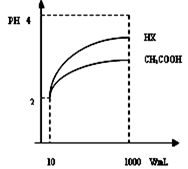
D c(OH-)/(H+)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数_____(填大于、等于或小于)醋酸平衡常数;理由是___________________________
II、工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
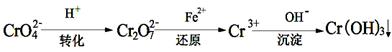
(1)转化过程中存在平衡2CrO42- + 2H+ Cr2O72- + H2O能说明反应到达平衡状态的是
Cr2O72- + H2O能说明反应到达平衡状态的是
A.CrO42-和Cr2O72-的浓度相同 B.2ν(Cr2O72-)=ν(CrO42-)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1L转化后所得溶液中含铬元素质量为28.6g,CrO42-有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。①转化后所得溶液中c(Cr2O72-)=
②已知:常温下该反应的平衡常数K=1014,上述转化后所得溶液的pH为
(3)还原过程中的离子反应方程式
(4)若常温下Ksp(Cr(OH)3)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
| | HA | H2B | HC | |
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | | | | |
A c(H+) B c(H+)/c(CH3COOH) C c(H+)·c(OH-)
D c(OH-)/(H+)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数_____(填大于、等于或小于)醋酸平衡常数;理由是___________________________

II、工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。

(1)转化过程中存在平衡2CrO42- + 2H+
 Cr2O72- + H2O能说明反应到达平衡状态的是
Cr2O72- + H2O能说明反应到达平衡状态的是A.CrO42-和Cr2O72-的浓度相同 B.2ν(Cr2O72-)=ν(CrO42-)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1L转化后所得溶液中含铬元素质量为28.6g,CrO42-有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。①转化后所得溶液中c(Cr2O72-)=
②已知:常温下该反应的平衡常数K=1014,上述转化后所得溶液的pH为
(3)还原过程中的离子反应方程式
(4)若常温下Ksp(Cr(OH)3)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
27.(16分)I、(1)(2分,错一个扣1分,扣完为止)
(2)A(2分)(3)大于(2分) II、(1)CD(2分) (2) ①0.25mol/L(2分)②6(2分)
(3) Cr2O72-+ 6Fe2++14H+ ="==" 6Fe3++ 2Cr3++ 7H2O (2分) (4)5(2分)
| | HA | H2B | HC | |
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | 1.8×10-5 | 4.3×10-7 | 5.6×10-11 | 4.9×10-10 |
(3) Cr2O72-+ 6Fe2++14H+ ="==" 6Fe3++ 2Cr3++ 7H2O (2分) (4)5(2分)
I、(1)根据较强酸制取较弱酸的原理可知,反应①说明HA的酸性强于H2B的。②说明H2B的酸性强于HC的,但HB-的酸性弱于HC。③说明HA的酸性强于HC的,即酸性强弱为HA>H2B>HC>HB-。
(2)醋酸存在电离平衡,稀释有利于电离,即在稀释过程中氢离子和CH3COO-的物质的量是增加的,但其浓度是减小的,所以c(OH-)增大。醋酸分子减小,浓度也减小,水的离子积常数和温度有关,不变。所以答案选A。
II、(1)平衡时浓度不再发生变化,但物质的浓度不一定相等,所以A不正确。pH不变说明氢离子浓度不再发生变化,颜色的深浅和浓度有关,所以CD正确。速率之比是化学计量数之比,B不正确。答案选CD。
(2)设1L溶液中CrO42-的物质的量是xmol,则生成Cr2O72-的物质的量是10x/22mol。1L溶液中铬元素的物质的量为0.55mol,则生成Cr2O72-的物质的量是10/11×0.55mol×1/2=0.25mol,所以浓度为0.25mol/L。
(3)根据反应物和生成物可知,方程式为Cr2O72-+ 6Fe2++14H+ ="==" 6Fe3++ 2Cr3++ 7H2O。
(4)根据溶度积常数可知,此时c(OH-)= ,所以氢离子浓度为10-5mol/L,则pH是5.
,所以氢离子浓度为10-5mol/L,则pH是5.
(2)醋酸存在电离平衡,稀释有利于电离,即在稀释过程中氢离子和CH3COO-的物质的量是增加的,但其浓度是减小的,所以c(OH-)增大。醋酸分子减小,浓度也减小,水的离子积常数和温度有关,不变。所以答案选A。
II、(1)平衡时浓度不再发生变化,但物质的浓度不一定相等,所以A不正确。pH不变说明氢离子浓度不再发生变化,颜色的深浅和浓度有关,所以CD正确。速率之比是化学计量数之比,B不正确。答案选CD。
(2)设1L溶液中CrO42-的物质的量是xmol,则生成Cr2O72-的物质的量是10x/22mol。1L溶液中铬元素的物质的量为0.55mol,则生成Cr2O72-的物质的量是10/11×0.55mol×1/2=0.25mol,所以浓度为0.25mol/L。
(3)根据反应物和生成物可知,方程式为Cr2O72-+ 6Fe2++14H+ ="==" 6Fe3++ 2Cr3++ 7H2O。
(4)根据溶度积常数可知,此时c(OH-)=
 ,所以氢离子浓度为10-5mol/L,则pH是5.
,所以氢离子浓度为10-5mol/L,则pH是5.
练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
 H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大
H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大 4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”) N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求: N2O4,△H<0。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 ( )
N2O4,△H<0。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 ( ) 4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的75%,则化学方程式中的n值是( )
4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的75%,则化学方程式中的n值是( )