题目内容
某反应,在不同反应时间各物质的量变化情况如图所示。则该反应的反应物(用A、B、C的字母填写)化学方程式为 ;
若反应在5L的密闭容器中进行,反应进行到2min时用A表示的化学反应速率为 。2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态。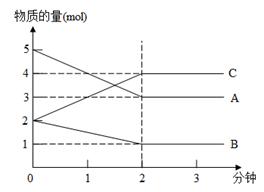
若反应在5L的密闭容器中进行,反应进行到2min时用A表示的化学反应速率为 。2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态。

2A+B  2C; 0.2mol/(L·min)。化学平衡
2C; 0.2mol/(L·min)。化学平衡
 2C; 0.2mol/(L·min)。化学平衡
2C; 0.2mol/(L·min)。化学平衡根据图像可知A和B是反应物,C是生成物。当反应进行到2min时,A、B、C、D的浓度不再发生变化,说明反应达到化学平衡状态。在2min内A、B、C的物质的量变化量分别为5mol-3mol=2mol、2mol-1mol=1mol、4mol-2mol-2mol,所以方程式为2A+B  2C。用A表示3的反应速率为
2C。用A表示3的反应速率为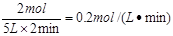 。
。
 2C。用A表示3的反应速率为
2C。用A表示3的反应速率为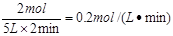 。
。
练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 2Z(g) 此反应达到平衡的标志是( )
2Z(g) 此反应达到平衡的标志是( ) 2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( )
2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( ) F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )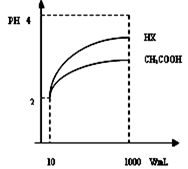
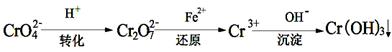
 Cr2O72- + H2O能说明反应到达平衡状态的是
Cr2O72- + H2O能说明反应到达平衡状态的是 N2O4(g);△H<0。则以下说法不正确的是 ( )
N2O4(g);△H<0。则以下说法不正确的是 ( )
 2SO3(g),下列判断不正确的是
2SO3(g),下列判断不正确的是 正(O2)=
正(O2)= H2(气)+I2(气),达到平衡时,下列说法正确的是 ( )
H2(气)+I2(气),达到平衡时,下列说法正确的是 ( )