题目内容
(16分)可逆反应2 Cl2 (g)+2H2O(g)  4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
(1)降低温度,Cl2的转化率__ _____,平衡常数K
(2)保持容器体积不变,加入He,则HCl的物质的量______________
(3) 保持容器体积不变,加入Cl2,则Cl2的转化率_________,平衡常数K
(4)若恒温恒容,反应从Cl2和H2O开始至平衡,在这个变化过程中,平均相对分子质量____。
(5)反应体系中加入催化剂对反应热是否有影响?______________________,原因是_______;
 4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)(1)降低温度,Cl2的转化率__ _____,平衡常数K
(2)保持容器体积不变,加入He,则HCl的物质的量______________
(3) 保持容器体积不变,加入Cl2,则Cl2的转化率_________,平衡常数K
(4)若恒温恒容,反应从Cl2和H2O开始至平衡,在这个变化过程中,平均相对分子质量____。
(5)反应体系中加入催化剂对反应热是否有影响?______________________,原因是_______;
(1)减小 减小 (2) 不变 (3) 减小 不变 (4) 减小
(5)没影响;催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响
(5)没影响;催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响
考查外界条件对化学平衡的影响。
根据反应式可知,该反应是体积增大的、吸热的可逆反应,所以降低温度平衡向正反应方向移动,转化率减小,平衡常数只与温度有关,所以平衡常数减小。保持容器体积不变,加入He,物质的浓度不变,平衡不移动,氯化氢的物质的量不变。增大氯气的浓度,氯气的转化率减小,平衡常数不变。如果从Cl2和H2O开始至平衡,体积增大。平均相对分子质量是混合气的质量和物质的量的比值,所以平均相对分子质量减小。催化剂能改变反应的活化能,但反应物和生成物的总能量是不变,反应热是不变的。
根据反应式可知,该反应是体积增大的、吸热的可逆反应,所以降低温度平衡向正反应方向移动,转化率减小,平衡常数只与温度有关,所以平衡常数减小。保持容器体积不变,加入He,物质的浓度不变,平衡不移动,氯化氢的物质的量不变。增大氯气的浓度,氯气的转化率减小,平衡常数不变。如果从Cl2和H2O开始至平衡,体积增大。平均相对分子质量是混合气的质量和物质的量的比值,所以平均相对分子质量减小。催化剂能改变反应的活化能,但反应物和生成物的总能量是不变,反应热是不变的。

练习册系列答案
相关题目
 2NH3(g),平衡时测得N2的转化率为12%,则在相同温度和压强下,平衡时混合气体的体积是反应前的
2NH3(g),平衡时测得N2的转化率为12%,则在相同温度和压强下,平衡时混合气体的体积是反应前的 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则: (1)2min内,平均反应速率v(O2)= ; v(SO3)= 。
(1)2min内,平均反应速率v(O2)= ; v(SO3)= 。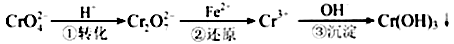
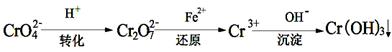
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O 2AB3(g)(△H<0)平衡体系的是
2AB3(g)(△H<0)平衡体系的是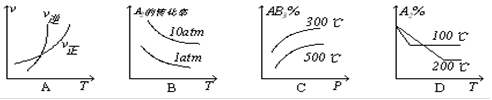
 2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( )
2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( )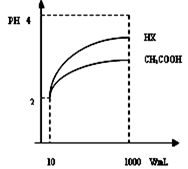
 Cr2O72- + H2O能说明反应到达平衡状态的是
Cr2O72- + H2O能说明反应到达平衡状态的是 2HF
2HF 