题目内容
(5分)(1)在一密闭容器中充入1molNO2,建立如下平衡:2NO2 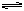 N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
(2)汽车尾气中的主要污染物有CO、NOx,CO分析仪是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。

(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,试回答下列问题:
①若电解质溶液为KOH溶液,构成燃料电池,则负极反应式为____________ ____,
②如把KOH改为稀H2SO4作电解质,则正极反应式为_____ ___________,
③如把H2改为甲烷,KOH作电解质,则负极反应式为
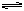 N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。(2)汽车尾气中的主要污染物有CO、NOx,CO分析仪是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。

| A.负极的电极反应式为:CO+O2—―2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,说明汽车尾气中CO的含量越高 |
①若电解质溶液为KOH溶液,构成燃料电池,则负极反应式为____________ ____,
②如把KOH改为稀H2SO4作电解质,则正极反应式为_____ ___________,
③如把H2改为甲烷,KOH作电解质,则负极反应式为
(1)b>a (2)B (3) ①2H2+4OH--4e-===4H2O ② O2+4H++4e-===2H2O ③ CH4-8e-+10 OH-=CO32-+7 H2O
(1)由于反应物和生成物都是一种,所以再通入NO2相当于增大压强,平衡向正反应方向移动,转化率增大。原电池中阳离子向正极移动,阴离子向负极移动。根据装置图可判断,a是负极,CO被氧化。b是正极,氧气被还原。所以选项B是错误的。(3)负极失去电子,所以氢气通入负极,氧气通入正极。若用甲醇作燃料,则甲醇在负极失去电子,由于溶液是氢氧化钾溶液,所以生成物是碳酸钾和水。

练习册系列答案
相关题目
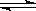 N2O4(g)△H<0。
N2O4(g)△H<0。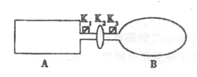
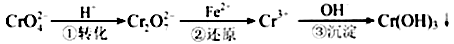
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O 2AB3(g)(△H<0)平衡体系的是
2AB3(g)(△H<0)平衡体系的是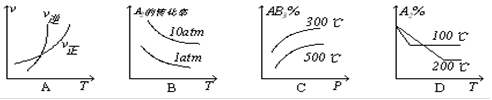
 2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( )
2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( ) 2NO2(g),△H>0,达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是( )
2NO2(g),△H>0,达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是( )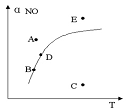
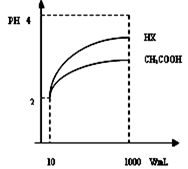
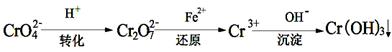
 Cr2O72- + H2O能说明反应到达平衡状态的是
Cr2O72- + H2O能说明反应到达平衡状态的是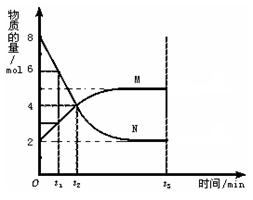
 C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到该条件下的最大限度的是
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到该条件下的最大限度的是