题目内容
【题目】已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相等,其电子总数为30;D和E可形成4核10个电子的分子。
试回答下列问题:
(1)写出这五种元素的名称:A___,B____,C___,D__,E___。
(2)用电子式表示离子化合物A2B的形成过程___。
(3)按要求表示下列化合物的原子构成关系:
①D元素形成单质的电子式___;
②E与B形成化合物的电子式___;
③A、B、E形成化合物的电子式___;
④D与E两元素按原子数目比为1∶3和2∶4构成分子M和N,M的电子式___,N的结构式___。
【答案】钠 氧 硫 氮 氢 ![]()
![]()
![]() 或
或![]()
![]()
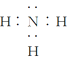
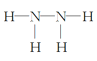
【解析】
A与B形成离子化合物A2B,A2B中所有离子的电子数相同,且电子总数为30,所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素;D和E可形成4核10电子的分子,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是NH3,结合原子序数D>E,可知D是N元素,E是H元素。
(1)由分析可知:A是Na,B为O,C是S,D是N,E为H,故答案为:钠、氧、硫、氮、氢;
(2)A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(3)①D为N元素,其单质为氮气,两个氮原子间形成叁键,D元素形成单质的电子式![]() ;故答案为:
;故答案为:![]()
②H与O形成的化合物H2O、H2O2,形成化合物的电子式![]() 或
或![]() ;故答案为:
;故答案为:![]() 或
或![]() ;
;
③Na、O、H形成的化合物NaOH为离子化合物,电子式![]() ;故答案为:
;故答案为:![]() ;
;
④D与E两元素按原子数目比为1∶3和2∶4构成分子M和N,M为NH3,中心原子氮形成三个共价键,N为N2H4分子中两个氮原子形成非极性共价键,M的电子式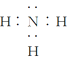 ,N的结构式
,N的结构式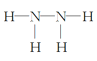 。故答案为:
。故答案为: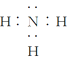 ;
;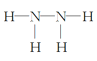 。
。

【题目】向200mLFeCl3与HCl的混合溶液中,分别加入一定量成分均匀的Fe、Cu混合固体,充分反应后剩余固体的质量及放出气体的体积(标准状况下测得)如下表所示。
加入固体质量/g | 9.00 | 18.0 | 27.0 |
剩余固体质量/g | 3.20 | 9.60 | 15.8 |
放出气体体积/L | 0 | 1.12 | 2.24 |
试计算:
(1)原混合液中c(Cl-)=____。
(2)混合固体中n(Fe):n(Cu)=____。