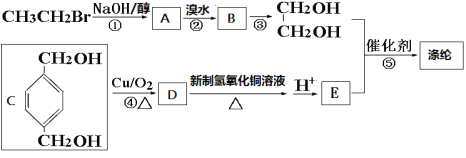
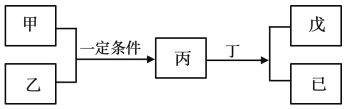
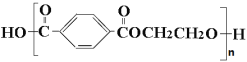题目内容
【题目】在恒温下使NH2COONH4 ( s) ![]() 2NH3 (g)+CO2 (g)达到平衡,不可以判断该反应达到化学平衡的是 ( )
2NH3 (g)+CO2 (g)达到平衡,不可以判断该反应达到化学平衡的是 ( )
A. V正(NH3) =2V逆(CO2)B. 密闭容器中氨气的体积分数不变
C. 密闭容器中总压强不变D. 密闭容器中混合气体的密度不变
【答案】B
【解析】
A.v正(NH3)=2v逆(CO2),表明正逆反应速率相等,该反应达到平衡状态,故A正确;
B.该反应中只有NH3(g)、CO2(g)为气体,二者体积之比始终为2:1,氨气的体积分数始终不变,不能根据氨气的体积分数判断平衡状态,故B错误;
C.该反应为气体体积增大的反应,压强为变量,当密闭容器中总压强不变时,表明达到平衡状态,故C正确;
D.NH2COONH4(s)为固态,则混合气体的质量为变量,根据ρ=![]() 可知,混合气体的密度为变量,当密闭容器中混合气体的密度不变时,表明该反应达到平衡状态,故D正确;
可知,混合气体的密度为变量,当密闭容器中混合气体的密度不变时,表明该反应达到平衡状态,故D正确;
故答案为B。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目