题目内容
【题目】向200mLFeCl3与HCl的混合溶液中,分别加入一定量成分均匀的Fe、Cu混合固体,充分反应后剩余固体的质量及放出气体的体积(标准状况下测得)如下表所示。
加入固体质量/g | 9.00 | 18.0 | 27.0 |
剩余固体质量/g | 3.20 | 9.60 | 15.8 |
放出气体体积/L | 0 | 1.12 | 2.24 |
试计算:
(1)原混合液中c(Cl-)=____。
(2)混合固体中n(Fe):n(Cu)=____。
【答案】4.00mol·L-1 1:1
【解析】
对比三组数据可知,当加入固体的质量为18g时,剩余的9.6g固体全部是铜,由此可计算n(Fe):n(Cu)为1:1;当加入固体的质量为27g时,由铁和铜的比例关系可判断剩余的15.8g固体的成分,由此可判断的铁与溶液中的铁离子和氢离子全部反应完全,可计算氯化铁和氯化氢的物质的量,即可求氯离子的物质的量浓度了。
(1)由分析知铁和铜的物质的量之比为1:1,当加入固体的质量为27g时,27g固体中有n(Fe)=n(Cu)=0.225mol,剩余固体中有14.4g铜,有1.4g的铁,则有0.2mol的铁与溶液中的铁离子和氢离子全部反应完全,由生成的氢气的体积可知,n(HCl)= 2n(H2)=0.2mol,与盐酸反应的铁的物质的量为n(Fe)= 0.1mol,与溶液中FeCl3反应的铁的物质的量为n(Fe)=0.2mol-0.1mol=0.1mol,则n(FeCl3)=0.2mol,溶液中的氯离子的浓度为c(Cl-)= ![]() ,故答案为:4.00mol·L-1;
,故答案为:4.00mol·L-1;
(2)对比三组数据可知,当加入固体的质量为18g时,剩余的9.6g固体全部是铜,由此可知n(Cu)= ![]() ,n(Fe)=
,n(Fe)= ![]() ,即n(Fe):n(Cu)= 1:1;故答案为:1:1。
,即n(Fe):n(Cu)= 1:1;故答案为:1:1。

 阅读快车系列答案
阅读快车系列答案【题目】二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸。在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:
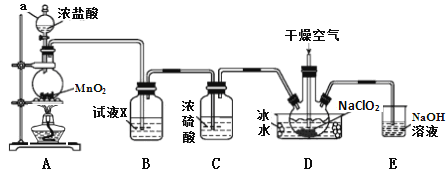
(1)仪器a的名称为_____________,装置A中反应的离子方程式为_______________。
(2)试剂X是_______________________。
(3)装置D中冰水的主要作用是___________。装置D内发生反应的化学方程式为_______________。
(4)装置E中主要反应的离子方程式为:____________________________。
(5)已知NaClO2饱和溶液在不同温度时析出的晶体情况如下表。
温度 | <38℃ | 38℃~60℃ | >60℃ |
析出晶体 | NaClO2·3H2O | NaClO2 | 分解成NaClO3和NaCl |
利用NaClO2溶液制得NaClO2晶体的操作步骤: 55℃蒸发结晶、_________、38~60℃的温水洗涤、低于60℃干燥。
(6)工业上也常用以下方法制备ClO2。
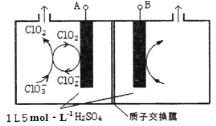
①酸性条件下双氧水与NaClO3反应,则反应的离子方程式为_______________________。
②如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。则阴极电极反应式为____________。


