题目内容
【题目】[选修3——物质结构与性质] 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)在Y的最高价氧化物分子中,Y原子轨道的杂化类型是_______________。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_______________________;Z的氢化物在固态时的密度比在液态时还小,其原因是_________
(3)Y与Z可形成YZ42-。
①YZ42-的空间构型为________________(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:_________________。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的
数目为_______。
(5)X与Y所形成化合物晶体的晶胞如图所:
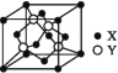
①在该晶体中,X离子的配位数为__________,与Y距离最近且距离相等的Y原子的数目为________。
②该晶胞的边长为a cm,该晶体的密度为__________________ g·cm-3。
【答案】sp2 水分子与乙醇分子之间形成氢键 在固态时水分子间主要以氢键结合,而氢键具有方向性,使水结成冰时体积膨胀,密度减小 正四面体 CCl4 16NA 4 12 388/ NA·a3(提示:晶胞中含有4个XY)
【解析】
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,则X原子核外电子数=2+8+18+2=30,则X原子序数为30,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,最外层电子数不超过8个,如果是K层,不超过2个,则Z原子核外电子数是8,为O元素;
(1)Y为S元素,最高正价为+6价,其氧化物为SO3,S原子价层电子对数=σ键数+孤电子对数;
(2)氢键能增大物质的溶解性;氢键具有方向性;
(3)①根据价层电子对互斥理论确定SO42-的空间构型;
②原子个数相等、价电子数相等的微粒为等电子体;
(4)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,一个化学式[Zn(NH3)4]Cl2中含有16个σ键,据此计算1mol该配合物中含有σ键的数目;
(5)晶胞为ZnS,根据晶胞结构确定S2-的配位数,以顶点的Zn2+为例,与之距离最近的Zn2+位于面心;利用均摊法计算该晶胞中S2-、Zn2+离子数目,从而确定其化学式;再结合ρ= 。
。
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,则X原子核外电子数=2+8+18+2=30,则X原子序数为30,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,最外层电子数不超过8个,如果是K层,不超过2个,则Z原子核外电子数是8,为O元素;
(1)Y为S元素,最高正价为+6价,其氧化物为SO3,S原子价层电子对数=σ键数+孤电子对数,即=3+![]() =3,故S原子轨道杂化类型为sp2杂化;
=3,故S原子轨道杂化类型为sp2杂化;
(2)Y的氢化物是H2S,Z的氢化物是H2O,H2S和乙醇分子之间不能形成氢键,H2O和乙醇分子之间能形成氢键,氢键的存在导致乙醇和水互溶;由于水在固态时水分子间主要以氢键结合,而氢键具有方向性,使水结成冰时体积膨胀,密度减小。导致固态H2O的密度比其液态时小;
(3)①SO42-的价层电子对个数=4+![]() ×(6+2-4×2)=4,且不含孤电子对,所以空间构型为正四面体;
×(6+2-4×2)=4,且不含孤电子对,所以空间构型为正四面体;
②SO42-的原子个数是5、价电子数是32,与硫酸根离子互为得电子体的有CCl4或SiCl4等;
(4)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,一个化学式[Zn(NH3)4]Cl2中含有16个σ键,则1mol该配合物中含有σ键的数目16NA;
(5)①由晶胞的结构可知,距离S2-最近的锌离子有4个,即S2-的配位数为4;晶胞中以顶点的Zn2+为例,与之距离最近的Zn2+位于面心,一个晶胞中共有3个,根据晶体的堆积方式可知,一个Zn2+被8个晶胞共用,且一个晶胞中距离最短的连线被两个晶胞共用,故符合条件的Zn2+共有![]() =12个;晶胞中S2-数目=8×
=12个;晶胞中S2-数目=8×![]() +6×
+6×![]() =4,Zn2+数目为4,即晶胞中含有4个ZnS,晶胞的质量为
=4,Zn2+数目为4,即晶胞中含有4个ZnS,晶胞的质量为![]() g,该晶胞的边长为acm,则体积为a3cm3,该物质的密度=
g,该晶胞的边长为acm,则体积为a3cm3,该物质的密度= =
=![]() g·cm-3。
g·cm-3。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案