题目内容
2.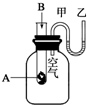 为了研究化学反应A+B=C+D的能量变化,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B=C+D的能量变化,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:(1)该反应为放反应(填“放热”或“吸热”).
(2)反应物化学键断裂吸收的能量低(填“高”或“低”)于生成物化学键形成放出的能量.
(3)写出一个符合题中条件的化学方程式:2Al+6HCl=AlCl3+3H2↑.
分析 (1)当向盛有A的试管中滴加试剂B时,看到U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质,可以判断反应的吸放热情况;
(2)根据反应物和生成物能量之间的关系与反应的吸放热之间的关系以及化学键断裂和生成过程的能量变化进行回答;
(3)常见的在常温下既能够进行的放热反应方程式,如金属与酸生成氢气的反应、酸碱中和反应等.
解答 解:(1)由于发生反应A+B═C+D,U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质可以判断该反应为放热反应,
故答案为:放热;
(2)化学反应中旧键断裂吸收能量,新键生成放出能量,该反应为吸热反应,则反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量,
故答案为:低;
(3)该反应为放热反应,且不需要加热既能够发生,如氧化钙与水反应生成氢氧化钙,反应方程式为:2Al+6HCl=AlCl3+3H2↑,
故答案为:2Al+6HCl=AlCl3+3H2↑.
点评 本题考查了化学反应中的吸热反应与放热反应,题目难度中等,注意掌握化学反应中能量变化与反应物、生成物总能量的关系,明确化学键断裂、形成与化学反应能量变化的关系.

练习册系列答案
相关题目
12.下列反应进行分类时,既属于氧化还原反应又属于化合反应的是( )
| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | 2KClO3$→_{△}^{MnO_{2}}$ 2KCl+3O2↑ | ||
| C. | CaO+H2O=Ca(OH)2 | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$ 2HCl |
13.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”.
Ⅰ.锂的原子结构示意图为 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).
Ⅱ.如图所示是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.
①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
(1)浸取时使用冷水的原因是Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率.
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
Ⅰ.锂的原子结构示意图为
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).Ⅱ.如图所示是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.

①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10 | 20 | 50 | 80 |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
10.下列组合不能形成配位键的是( )
| A. | Ag+、NH3 | B. | H2O、H+ | C. | CO3+、CO | D. | Ag+、H+ |
14.下列反应不可能在有机物中引入卤素原子的是( )
| A. | 取代反应 | B. | 加成反应 | C. | 消去反应 | D. | 氧化反应 |

 ;
;