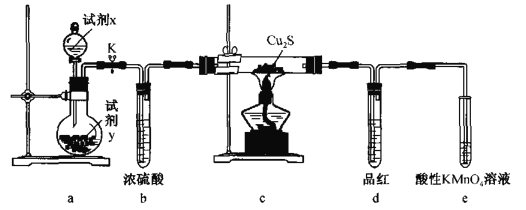
题目内容
【题目】某兴趣小组以海水晒盐后的苦囟![]() 含有
含有![]() 为原料,设计制备碘单质
为原料,设计制备碘单质![]() 的转化途径如图,下列说法不正确的是
的转化途径如图,下列说法不正确的是

A.生活中可直接使用![]() 淀粉试纸检验加碘盐中是否含有碘
淀粉试纸检验加碘盐中是否含有碘
B.途径Ⅲ发生反应的离子方程式可能是![]()
C.由图可知氧化性的强弱顺序为![]()
D.两种途径得到等量的碘,消耗氯气物质的量比为1:5
【答案】A
【解析】
![]() 加碘盐中含有
加碘盐中含有![]() ,其在酸性条件下可被
,其在酸性条件下可被![]() 还原生成
还原生成![]() ,故用淀粉
,故用淀粉![]() 试纸和食醋检验加碘盐,故A错误;
试纸和食醋检验加碘盐,故A错误;
B.根据途径Ⅲ可知![]() 将
将![]() 氧化成
氧化成![]() ,子方程式可能是
,子方程式可能是![]() ,故B正确;
,故B正确;
C.由途径I可知氧化性![]() ,由途径Ⅱ可知氧化性
,由途径Ⅱ可知氧化性![]() ,由途径Ⅲ可知氧化性
,由途径Ⅲ可知氧化性![]() ,故氧化性的强弱顺序为
,故氧化性的强弱顺序为![]() ,故C正确;
,故C正确;
D.根据转化关系![]() ,
,![]() ,两种途径得到等量的碘转移电子数之比为1:5,所以消耗氯气物质的量比为1:5,故D正确;
,两种途径得到等量的碘转移电子数之比为1:5,所以消耗氯气物质的量比为1:5,故D正确;
故选:A。

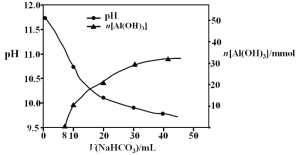
【题目】(1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | V(H2O)/mL |
① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验__________(填实验编号);若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为________和________。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。
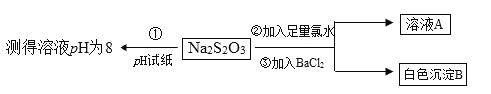
实验操作①中测试时pH试纸的颜色应该接近_____________。
A.红色 B.黄色 C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的_____性。
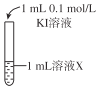
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实狯 | 现象 | ||
| 编号 | 溶液x | |
I | 0.1mol/LFe(NO3)2,pH≈l | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
Ⅱ | KNO3和HNO3,其中c(NO3-)=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
IV | 0.1mol/LCu(NO3)2 | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式___,该条件下氧化性:Fe3+___I2(选填“>”或“<”)。
③实验Ⅱ的目的是___。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与CuI沉淀有关,故不能确定氧化性:Cu2+>I2,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+___I2(选填“>”或“<”)。
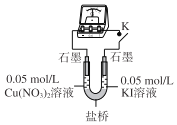
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是___。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。