题目内容
6.150℃、1.01×105 Pa时,aL乙炔和aL丙烯的混合气体与过量的bLO2混合、点燃,使这两种烃充分燃烧后,再恢复到原状况,此时混合气体的体积为( )| A. | 10aL | B. | (2a+b)L | C. | (b-a)L | D. | 无法计算 |
分析 氧气过量时,燃烧发生反应:2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O、2C3H6+9O2$\stackrel{点燃}{→}$6CO2+6H2O,恢复150℃、1.01×105 Pa时,生成的水为气态,由方程式可知,2体积乙炔燃烧后气体体积减少1体积,而2体积丙烯燃烧后气体体积增大1体积,故燃烧后混合物气体的体积不变.
解答 解:氧气过量时,燃烧发生反应:2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O、2C3H6+9O2$\stackrel{点燃}{→}$6CO2+6H2O,恢复150℃、1.01×105 Pa时,生成的水为气态,由方程式可知,2体积乙炔燃烧后气体体积减少1体积,而2体积丙烯燃烧后气体体积增大1体积,故燃烧后混合物气体的体积不变,即燃烧后混合气体的体积为(aL+aL+bL)=(2a+b)L,故选B.
点评 本题考查化学方程式有关计算,注意根据差量法进行分析解答,避免计算的繁琐,较好的考查学生分析计算能力,难度不大.

练习册系列答案
相关题目
16.下列有关化学反应速率的说法中正确的是( )
| A. | 用铁片与硫酸制取氢气时,硫酸浓度越大制取氢气的速率一定越快 | |
| B. | 等质量的锌粉和锌片与等物质的量浓度的盐酸反应,反应速率相等 | |
| C. | 升高温度对于放热反应可以加快反应速率,对于吸热反应可以减小反应速率 | |
| D. | 可逆反应中加入催化剂可以同时加快正逆反应速率 |
17.对于合成氨工业,只从提高原料转化率看,从下列条件中选择最适宜的组合是( )
①高温 ②低温 ③低压 ④高压 ⑤催化剂 ⑥加氨 ⑦除氨.
①高温 ②低温 ③低压 ④高压 ⑤催化剂 ⑥加氨 ⑦除氨.
| A. | ②④⑤ | B. | ②④⑦ | C. | ①④⑤ | D. | ②③⑥ |
1.下列表示物质结构的化学用语或模型图正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | 14C的原子结构示意图: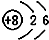 | ||
| C. | 聚氯乙烯的结构简式: | D. | 丙烷分子的球棍模型示意图: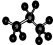 |
11.下列说法正确的是( )
| A. | 按系统命名法: 的名称为3,3,6三甲基4乙基庚烷 的名称为3,3,6三甲基4乙基庚烷 | |
| B. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸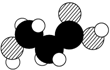 | |
| C. | 能用新制氢氧化铜和NaOH溶液鉴别甘油、葡萄糖溶液、乙酸钠溶液 | |
| D. | 木糖醇( 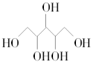 )和葡萄糖( )和葡萄糖(  )互为同系物,均属于糖类 )互为同系物,均属于糖类 |
18.下列有关元素化合物的叙述中正确的是( )
| A. | 钠在空气中燃烧生成白色的氧化钠固体 | |
| B. | 检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液 | |
| C. | 二氧化硫的水溶液能使紫色石蕊溶液变红,随后使之褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
15.在短周期主族元素中,族序数与原子的核电荷数、电子层数均为奇数的有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |