题目内容
(14分)铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2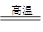 2Cu + SO2
2Cu + SO2
方法二:湿法炼铜:CuSO4 + Fe FeSO4 + Cu
FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
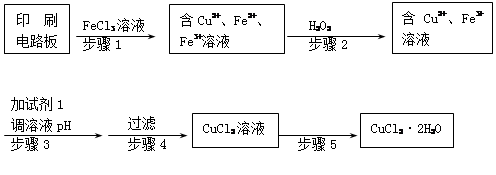
①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2
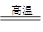 2Cu + SO2
2Cu + SO2方法二:湿法炼铜:CuSO4 + Fe
 FeSO4 + Cu
FeSO4 + Cu上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
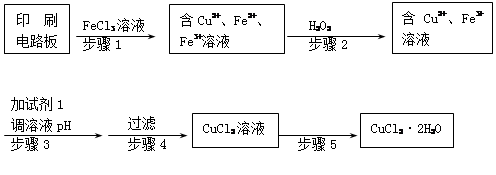
①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
Ⅰ湿法炼铜(或方法二)不会产生污染空气的气体(或湿法炼铜不需要外界提供能量); 3:2
Ⅱ ① 2Fe2++ H2O2 +2H+ = 2Fe3+ + 2H2O
②CuCl2在溶液中可以发生水解反应: CuCl2+2H2O Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
③ 向漏斗中加少量蒸馏水(水)至没过沉淀,静置滤干后重复操作2~3次。
④ CuO[或Cu(OH)2] ; 4×10-8mol/L
Ⅱ ① 2Fe2++ H2O2 +2H+ = 2Fe3+ + 2H2O
②CuCl2在溶液中可以发生水解反应: CuCl2+2H2O
 Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解③ 向漏斗中加少量蒸馏水(水)至没过沉淀,静置滤干后重复操作2~3次。
④ CuO[或Cu(OH)2] ; 4×10-8mol/L
试题分析:Ⅰ第一种方法会产生大气污染物SO2,而且要消耗大量的能量,而第二种方法在常温下就可以发生,产物都是无污染的。因此第二种方法好。由反应方程式可以看出产生2mol的Cu电子转移6mol,因此产生640gCu即10mol的Cu,电子转移30mol;而在湿法炼铜中产生1mol的Cu电子转移2mol,因此产生640gCu即10mol的Cu,电子转移20mol,所以转移电子的物质的量的比为3:2。Ⅱ①根据图示可知在步骤2中反应的离子方程式是2Fe2++ H2O2 +2H+ = 2Fe3+ + 2H2O;②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,是因为CuCl2是强酸强碱盐,在溶液中可以发生水解反应: CuCl2+2H2O
 Cu(OH)2+2HCl,滴加浓盐酸,就可以抑制水解。③步骤4中洗涤沉淀的操作为向漏斗中加少量蒸馏水(水)至没过沉淀,待水滤干后重复操作2~3次。④步骤3中可选用的“试剂1”是既可以消耗H+同时又不引入杂质离子的物质,可以是CuO[或Cu(OH)2] ,pH=4,c(OH-)=10-10mol/L;由于Ksp(Fe(OH)3)=4×10-38,所以c(Fe3+)·c3(OH-)=4×10-38; c(Fe3+)·c3(OH-)=4×10-38÷10-30=4×10-8mol/L。
Cu(OH)2+2HCl,滴加浓盐酸,就可以抑制水解。③步骤4中洗涤沉淀的操作为向漏斗中加少量蒸馏水(水)至没过沉淀,待水滤干后重复操作2~3次。④步骤3中可选用的“试剂1”是既可以消耗H+同时又不引入杂质离子的物质,可以是CuO[或Cu(OH)2] ,pH=4,c(OH-)=10-10mol/L;由于Ksp(Fe(OH)3)=4×10-38,所以c(Fe3+)·c3(OH-)=4×10-38; c(Fe3+)·c3(OH-)=4×10-38÷10-30=4×10-8mol/L。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
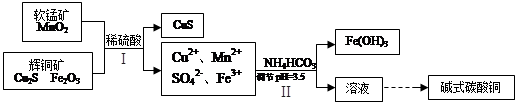
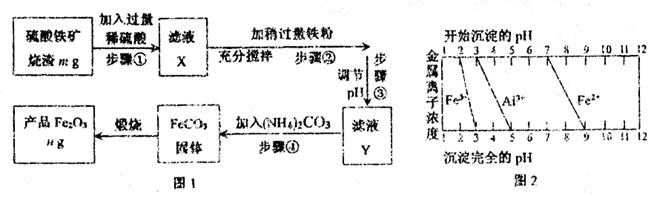
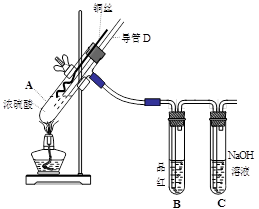
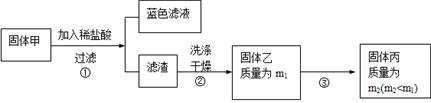 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。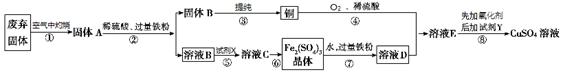
 Q
Q Q溶液
Q溶液 M+N
M+N