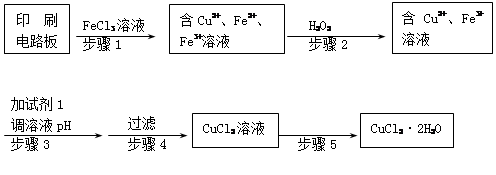题目内容
(16分)辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:
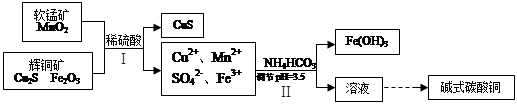
①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是 ;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过 mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:
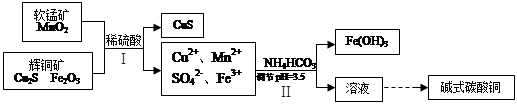
①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是 ;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过 mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
(1)3NA (2)正 ③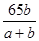 (2)①2Cu+O2+CO2+H2O=Cu2(OH)2CO3 ②HCO3-+H+=H2O+CO2↑
(2)①2Cu+O2+CO2+H2O=Cu2(OH)2CO3 ②HCO3-+H+=H2O+CO2↑
③iii)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O ④2×1021-a
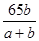 (2)①2Cu+O2+CO2+H2O=Cu2(OH)2CO3 ②HCO3-+H+=H2O+CO2↑
(2)①2Cu+O2+CO2+H2O=Cu2(OH)2CO3 ②HCO3-+H+=H2O+CO2↑③iii)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O ④2×1021-a
试题分析:(1)①根据反应Cu2S+O2=2Cu+SO2可知,反应中氧元素化合价和铜元素化合价降低,只有硫元素的化合价从-2价升高到+4价,失去6个电子,所以当产生标况下11.2L气体即0.5mol二氧化硫时,转移电子物质的量是0.5mol×6=3mol,其数目为3NA。
②将粗铜进行电解精炼,粗铜应与外电源的正极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,增加的质量即为析出的铜,电解质溶液增重bg,设参加反应的锌和铜的质量分别是mg、ng,则m+n-a=b,根据电子守恒可知
 ,解得m=65b,则粗铜中含锌的质量分数为
,解得m=65b,则粗铜中含锌的质量分数为 =
=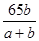 。
。(2)①铜单质放置于潮湿空气中,容易与氧气、水、二氧化碳等结合生成碱式碳酸铜为生锈,反应化学方程式是2Cu+O2+CO2+H2O=Cu2(OH)2CO3。
②步骤Ⅱ是调节溶液pH的,因此碳酸氢铵与氢离子反应,则反应的离子方程式为HCO3-+H+=H2O+CO2↑。
③硫酸铁起催化作用,则第二步中生成的硫酸亚铁需要在第三步中重新被氧化生成硫酸铁,因此反应的化学方程式为MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O。
④溶液的pH=3.5,则溶液中氢氧根浓度是10-10.5mol/L,所以根据氢氧化铜的溶度积常数可知,铜离子的浓度不能超过
 =2×1021-a mol/L。
=2×1021-a mol/L。
练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目

 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu