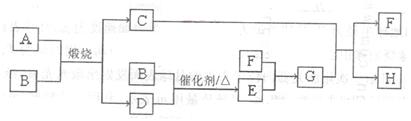
题目内容
(16分)铜与浓硫酸反应,实验装置如图所示。
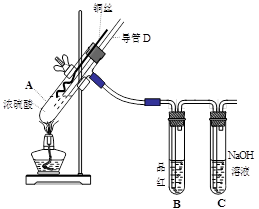
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
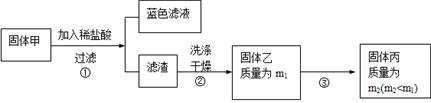 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为 。
(5)结论:甲中有CuO,还肯定含有的物质是 。

(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
|
 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为 。
(5)结论:甲中有CuO,还肯定含有的物质是 。
33.(16分)(1)Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O (2分)、品红溶液褪色(2分)、吸收多余的SO2,防止污染空气(2分)
(2)液面下;防倒吸 (4分)
(3)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
(4)2Cu+O2△2CuO (2分)
(5)CuS(2分)
(2)液面下;防倒吸 (4分)
(3)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
(4)2Cu+O2△2CuO (2分)
(5)CuS(2分)
试题分析: (1) 该实验研究的是铜与浓硫酸的反应,因此在A装置中发生的反应方程式为Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O。反应中有SO2生成,因此B中的品红溶液被漂白褪色,C试管起到吸收过量SO2的目的,防止SO2污染空气。
(2) 由于A装置是制备SO2的发生装置,所以导管D的下端必须插入溶液中,才能防止产生的SO2不会从导管D中逸出来;而导管D的作用是在实验结束后用于排除A装置的SO2,同时能够平衡A和B中气压,防止B中液体倒吸。具体操作就是把D下端从溶液中提起。
(3) 煅烧的实验用具必须使用耐高温的坩埚,而与坩埚配套使用的还有泥三角、坩埚钳等。
(4)根据题中的判断,该固体甲可能是CuO、Cu2O、CuS、Cu2S,因此用稀盐酸溶解,根据已知的反应,反应得到的固体乙可能是Cu、CuS、Cu2S,对固体乙进行煅烧,因此除了已知的几个煅烧反应外,还可能发生的反应为单质铜的煅烧2Cu+O2△2CuO。
(5) 根据(4)的分析,利用反应的方程式对各种成分煅烧结果进行推断分析,若Cu煅烧,煅烧生成CuO使质量增重;若CuS煅烧,煅烧产生CuO使质量减小;若Cu2S煅烧,煅烧生成CuO是质量不变。因此要满足流程中煅烧前后质量减小,则固体中必须还含有能使煅烧前后质量减小的CuS。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu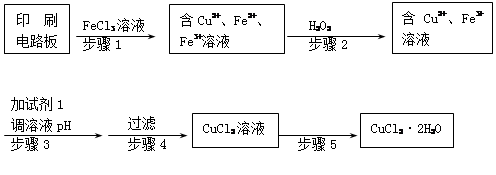

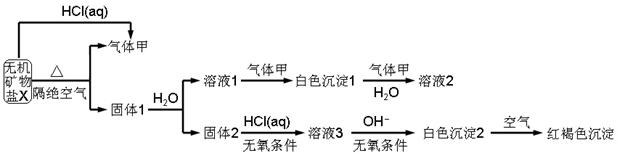
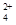 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。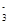 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。