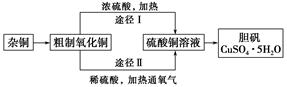
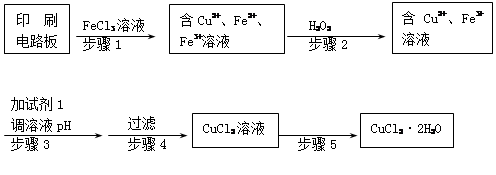题目内容
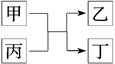
已知下列转化关系中,M、N均为单质,则M可能是( )。
M+N Q
Q Q溶液
Q溶液 M+N
M+N
M+N
 Q
Q Q溶液
Q溶液 M+N
M+N| A.Na | B.Al | C.Fe | D.Cu |
D
Na、Al、Fe均为活泼金属,电解相关溶液不能制取其单质;电解铜盐溶液可以生成铜单质,转化关系可能是Cu+Cl2 CuCl2
CuCl2 CuCl2溶液
CuCl2溶液 Cu+Cl2。
Cu+Cl2。
 CuCl2
CuCl2 CuCl2溶液
CuCl2溶液 Cu+Cl2。
Cu+Cl2。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
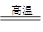 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu