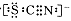题目内容
(15分)
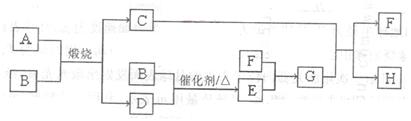
某学习小组利用某工业废弃固体(主要成分为Cu2S和Fe2O3)来研究相关物质的制备。设计方案如图所示:
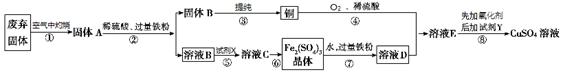
已知:Ksp[Cu(OH)2]=6.0×10-20 ,Ksp[Fe(OH)2]=1.6×10-14 ,Ksp[Fe(OH)3]=1.0×10-38
(1) 废弃固体在空气中灼烧发生反应(有2种元素被氧化)的化学方程式为______。
(2) 溶液C通过_______、_________、过滤等操作得到Fe2(SO4)3晶体。
(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和 。溶液D在这一过程中所起的作用是_______。
(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 ,溶液的pH至少调节为________。
某学习小组利用某工业废弃固体(主要成分为Cu2S和Fe2O3)来研究相关物质的制备。设计方案如图所示:

已知:Ksp[Cu(OH)2]=6.0×10-20 ,Ksp[Fe(OH)2]=1.6×10-14 ,Ksp[Fe(OH)3]=1.0×10-38
(1) 废弃固体在空气中灼烧发生反应(有2种元素被氧化)的化学方程式为______。
(2) 溶液C通过_______、_________、过滤等操作得到Fe2(SO4)3晶体。
(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和 。溶液D在这一过程中所起的作用是_______。
(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 ,溶液的pH至少调节为________。
(1)Cu2S + 2O2 2CuO + SO2 (2)蒸发浓缩;冷却结晶
2CuO + SO2 (2)蒸发浓缩;冷却结晶
(3)Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4;催化剂 (4)CuO(或Cu(OH)2、CuCO3等);3
 2CuO + SO2 (2)蒸发浓缩;冷却结晶
2CuO + SO2 (2)蒸发浓缩;冷却结晶 (3)Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4;催化剂 (4)CuO(或Cu(OH)2、CuCO3等);3
试题分析:(1) 在废弃固体中Fe2O3已经是最高价氧化物,不能再发生反应,而Cu2S在空气中灼烧会发生反应产生SO2和CuO。反应的化学方程式为Cu2S + 2O2
 2CuO + SO2 。(2)把灼烧后的固体加入到硫酸中,会发生反应得到Fe2(SO4)3和CuSO4。再加入过量的Fe粉,发生反应:Fe2(SO4)3+Fe=3FeSO4;CuSO4+Fe= Cu+FeSO4。过滤得到的滤液中含有FeSO4。然后加入过量的H2O2,发生反应得到溶液C:Fe2(SO4)3。溶液C通过蒸发浓缩;冷却结晶、过滤等操作得到Fe2(SO4)3晶体。(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和Fe2(SO4)3+Cu = CuSO4+2FeSO4。可见溶液D在这一过程中参加反应,但是最后又变为原来的物质。说明溶液D所起的作用是催化剂。(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中含有CuSO4和FeSO4。加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 CuO或Cu(OH)2、CuCO3,因为c(Fe3+)·c3(OH-)≥1.0×10-38; c(Fe3+)=10-5 mol/L,所以c3(OH-)≥1.0×10-33. c(OH-)≥1.0×10-11 mol/L;c(H+)≤.0×10-3 mol/L。溶液的pH至少调节为3。
2CuO + SO2 。(2)把灼烧后的固体加入到硫酸中,会发生反应得到Fe2(SO4)3和CuSO4。再加入过量的Fe粉,发生反应:Fe2(SO4)3+Fe=3FeSO4;CuSO4+Fe= Cu+FeSO4。过滤得到的滤液中含有FeSO4。然后加入过量的H2O2,发生反应得到溶液C:Fe2(SO4)3。溶液C通过蒸发浓缩;冷却结晶、过滤等操作得到Fe2(SO4)3晶体。(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和Fe2(SO4)3+Cu = CuSO4+2FeSO4。可见溶液D在这一过程中参加反应,但是最后又变为原来的物质。说明溶液D所起的作用是催化剂。(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中含有CuSO4和FeSO4。加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 CuO或Cu(OH)2、CuCO3,因为c(Fe3+)·c3(OH-)≥1.0×10-38; c(Fe3+)=10-5 mol/L,所以c3(OH-)≥1.0×10-33. c(OH-)≥1.0×10-11 mol/L;c(H+)≤.0×10-3 mol/L。溶液的pH至少调节为3。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu

 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。