题目内容
【题目】过碳酸钠是一种多用途的新型漂白剂,化学式可表示为aNa2CO3·bH2O2,过碳酸钠溶于水分解成Na2CO3和H2O2。
(1)FeOCl常用作过碳酸钠使用时的催化剂。FeCl3·6H2O在250℃时分解可得到FeOCl,该反应的化学方程式为______________________________________。
(2)测定某样品中过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
步骤Ⅰ:称取样品0.800 0 g于锥形瓶中,加水溶解,滴加甲基橙作指示剂,用0.200 0 mol·L-1H2SO4溶液滴定至终点,消耗硫酸25.00 mL。
步骤Ⅱ:另称取样品0.800 0 g于锥形瓶中,加水溶解,加稀硫酸酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点(滴定过程中MnO被还原为Mn2+),消耗KMnO4溶液30.00 mL。
①步骤Ⅰ中,滴定终点的现象是____________________。
②步骤Ⅱ中,若样品溶于水酸化后放置一段时间,然后再进行滴定,则过碳酸钠化学式中a∶b的测定结果将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该过碳酸钠化学式(写出计算过程)。___________
【答案】FeCl3·6H2O![]() FeOCl+2HCl↑+5H2O↑ 黄色变为橙色 偏大 2Na2CO3·3H2O2
FeOCl+2HCl↑+5H2O↑ 黄色变为橙色 偏大 2Na2CO3·3H2O2
【解析】
(1)FeCl3·6H2O在250℃时分解可得到FeOCl,根据物料守恒书写该反应的化学方程式;
(2)①步骤Ⅰ中,甲基橙作指示剂,终点时,甲基橙由黄色变为橙色;
②步骤Ⅱ中,KMnO4溶液滴定至终点用来测定样品中双氧水的含量,双氧水不稳定;
③根据步骤Ⅰ、Ⅱ分别计算出碳酸钠和双氧水的含量,进而计算确定该过碳酸钠化学式。
(1)FeCl3·6H2O在250℃时分解可得到FeOCl,根据物料守恒,该反应的化学方程式;FeCl3·6H2O![]() FeOCl+2HCl↑+5H2O↑;
FeOCl+2HCl↑+5H2O↑;
(2)①步骤Ⅰ中,甲基橙作指示剂,终点时,最后一滴硫酸过量,甲基橙由黄色变为橙色,滴定终点的现象是:加入最后一滴硫酸标准液,甲基橙由黄色变为橙色,且半分钟内不变色;
②步骤Ⅱ中,样品溶于过碳酸钠分解成Na2CO3和H2O2,酸化后放置一段时间双氧水会发生分解生成水,双氧水的含量减少,再用KMnO4溶液进行滴定时,与双氧水发生反应,消耗标准溶液的体积减小,导致测得的双氧水的量减小,即b减小,则过碳酸钠化学式中a∶b的测定结果将偏大;
③根据步骤Ⅰ,硫酸滴定样品溶液中的碳酸钠,反应为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,则n(Na2CO3)=n(H2SO4)= 0.200 0 mol·L-1×25.00 ×10-3L=0.005mol;
根据步骤Ⅱ,用高锰酸钾滴定溶液中的双氧水,测定其含量,离子反应为2MnO4ˉ+5H2O2+6H+=5O2↑+2Mn2++H2O,则n(H2O2)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.100 0 mol·L-1×30.00 ×10-3L=0.0075mol;则a∶b= n(Na2CO3):n(H2O2)=0.005:0.0075=2:3,则过碳酸钠化学式为2Na2CO3·3H2O2。
×0.100 0 mol·L-1×30.00 ×10-3L=0.0075mol;则a∶b= n(Na2CO3):n(H2O2)=0.005:0.0075=2:3,则过碳酸钠化学式为2Na2CO3·3H2O2。

【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
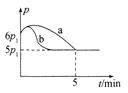
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。
②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。