题目内容
【题目】偏二甲肼![]() 为
为![]() 价
价![]() 与
与![]() 是常用的火箭推进剂,发生的化学反应如下:
是常用的火箭推进剂,发生的化学反应如下:![]()
![]() ,下列说法不正确的是
,下列说法不正确的是 ![]()
![]()
A.该反应在任何情况下都能自发进行
B.![]() 含有
含有![]() 共价键
共价键
C.反应中,氧化产物为![]() ,还原产物为
,还原产物为![]()
D.反应中,生成![]() 时,转移
时,转移![]()
【答案】C
【解析】
A.该反应是熵增反应,即![]() ,又是放热反应,即
,又是放热反应,即![]() ,则
,则![]() 一定小于零,故该反应在任何情况下都能自发进行,故A正确;
一定小于零,故该反应在任何情况下都能自发进行,故A正确;
B.一个![]() 分子中含有11个共价键,则
分子中含有11个共价键,则![]() 含有11mol共价键,故B正确;
含有11mol共价键,故B正确;
C.反应中,偏二甲肼中N元素化合价由![]() 价升高为0价,
价升高为0价,![]() 中N元素化合价由
中N元素化合价由![]() 价降低为0价,则
价降低为0价,则![]() 既是氧化产物又是还原产物,偏二甲肼中碳元素由
既是氧化产物又是还原产物,偏二甲肼中碳元素由![]() 价升高为
价升高为![]() 价,
价,![]() 为氧化产物,故C错误;
为氧化产物,故C错误;
D.![]() 中N元素化合价由
中N元素化合价由![]() 价降低为0价,生成1mol
价降低为0价,生成1mol![]() 时消耗
时消耗![]() ,转移8mol
,转移8mol![]() ,故D正确;
,故D正确;
故答案选C。

 名校课堂系列答案
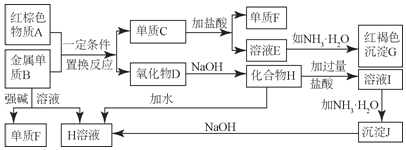
名校课堂系列答案【题目】碱式硫酸铁[Fe(OH)SO4]可用做净水剂、媒染剂等。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的部分工艺如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ中氧化还原反应的离子方程式__________________ 、 ___________________。
(2)反应Ⅱ中加入NaHCO3调节体系的pH在_____________范围内。
(3)反应Ⅲ中生成的气体遇空气变红棕色,该反应的离子方程式是_____________________。
(4)若反应Ⅲ中通入O2可减少NaNO2的用量,当消耗1molO2可节约n(NaNO2)=_____mol。
(5)用稀硫酸调节体系的pH时,若硫酸加入量过少,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理说明其原因______________________________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为____________________________