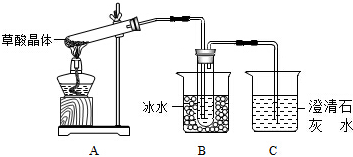
题目内容
8.向1L某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L.反应过程中溶液的体积变化忽略不计,则下列说法中正确的是( )| A. | 原溶液的浓度约为0.13mol/L | B. | 反应后溶液中c(Fe3+)=0.1mol/L | ||
| C. | 反应后溶液中c(Fe3+)=c(Fe2+) | D. | 原溶液中c(Br-)=0.4mol/L |
分析 还原性Fe2+>Br-,所以FeBr2溶液中通入Cl2,Cl2先将Fe2+氧化为Fe3+,Fe2+反应完毕,若Cl2有剩余,剩余Cl2再将Br-氧化为Br2,最后溶液中含有Br-,说明Cl2完全反应,转化为Cl-;
1.12L(标况下)Cl2的物质的量为0.05mol,根据氯元素守恒可知n(Cl-)=0.1mol,则溶液中n(Br-)=3n(Cl-)=0.3mol;
若溶液中Br-参加反应,令溶液中FeBr2物质的量为xmol,则根据电子转移守恒,x+(2x-0.3)=0.1,解得x=$\frac{2}{15}$mol,$\frac{2}{15}$molFe2+的提供电子为$\frac{2}{15}$mol大于0.05molCl2能够获得电子0.1mol,且(2x-0.3)<0,不符合题意;
若溶液中Br-未参加反应,则原溶液中的Fe2+物质的量为0.15mol,0.15molFe2+能够提供电子0.15mol,0.05molCl2能够获得电子0.1mol,小于0.15molFe2+能够提供电子0.15mol,Fe2+有剩余,符合题意,所以原溶液含有FeBr20.15mol,根据电子转移守恒,被氧化的Fe2+为0.05mol×2=0.1mol,生成Fe3+为0.1mol,剩余Fe2+为0.15mol-0.1mol=0.05mol,结合选项具体解答.
解答 解:还原性Fe2+>Br-,所以FeBr2溶液中通入Cl2,Cl2先将Fe2+氧化为Fe3+,Fe2+反应完毕,若Cl2有剩余,剩余Cl2再将Br-氧化为Br2,最后溶液中含有Br-,说明Cl2完全反应,转化为Cl-;
1.12L(标况下)Cl2的物质的量为0.05mol,根据氯元素守恒可知n(Cl-)=0.1mol,则溶液中n(Br-)=3n(Cl-)=0.3mol.
若溶液中Br-参加反应,令溶液中FeBr2物质的量为xmol,则根据电子转移守恒,x+(2x-0.3)=0.1,解得x=$\frac{2}{15}$mol,$\frac{2}{15}$molFe2+的提供电子为$\frac{2}{15}$mol大于0.05molCl2能够获得电子0.1mol,且(2x-0.3)<0,不符合题意.
若溶液中Br-未参加反应,则原溶液中的Fe2+物质的量为0.15mol,0.15molFe2+能够提供电子0.15mol,0.05molCl2能够获得电子0.1mol,小于0.15molFe2+能够提供电子0.15mol,Fe2+有剩余,符合题意,所以原溶液含有FeBr20.15mol,根据电子转移守恒,被氧化的Fe2+为0.05mol×2=0.1mol,生成Fe3+为0.1mol,剩余Fe2+为0.15mol-0.1mol=0.05mol.
A、由上述分析可知,原溶液含有FeBr20.15mol,所以原溶液的浓度为$\frac{0.15mol}{1L}$=0.15mol/L,故A错误;
B、由上述分析可知,反应后溶液中生成Fe3+为0.1mol,反应后溶液中c(Fe3+)=$\frac{0.1mol}{1L}$=0.1mol/L,故B正确;
C、由上述分析可知,反应后溶液中生成Fe3+为0.1mol,反应后溶液中c(Fe3+)=$\frac{0.1mol}{1L}$=0.1mol/L,剩余Fe2+为0.15mol-0.1mol=0.05mol,所以c(Fe2+)=$\frac{0.05mol}{1L}$=0.05mol/L,故C错误;
D、由上述分析可知,原溶液含有FeBr20.15mol,原溶液中c(Br-)=$\frac{0.15mol×2}{1L}$=0.3mol/L,故D错误.
故选:B.
点评 本题考查氧化还原反应计算,难度较大,关键根据电子转移守恒及溶液中c(Br-)=3c(Cl-)关系判断原溶液中FeBr2物质的量.

 口算能手系列答案
口算能手系列答案| A. | $\frac{1}{2}$倍 | B. | $\frac{1}{100}$倍 | C. | 100倍 | D. | 无法确定 |
| A. | 2-甲基丁烷与正丁烷的一氯取代产物的种类相同 | |
| B. | 分子式为C4H8O2且含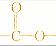 基团的同分异构体共有4种 基团的同分异构体共有4种 | |
| C. | 与CH2═CHCH3与HCl发生加成反应可得到2种有机物 | |
| D. | 分子式C8H10的苯的同系物共有3种结构 |
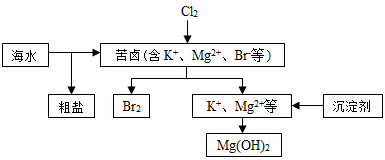
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |