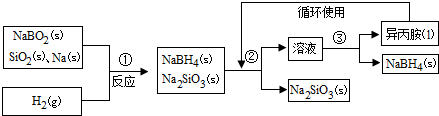
题目内容
1.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,则下列叙述正确的是( )| A. | 中性溶液的 AG=0 | B. | 酸性溶液的AG<0 | ||
| C. | 常温下0.1mol/LNaOH溶液的AG=12 | D. | 常温下0.1mol/L盐酸溶液的AG=12 |
分析 A.中性溶液中,氢离子浓度等于氢氧根离子浓度;
B.酸性溶液中,氢离子浓度大于氢氧根离子浓度,氢离子浓度比氢氧根离子的比值大于1;
C.c(H+)=$\frac{{K}_{w}}{C(O{H}^{-})}$,0.1mol•L-1氢氧化钠溶液中氢离子浓度为1×10-13mol•L-1,氢氧根离子浓度为0.1mol•L-1;
D.0.1mol•L-1盐酸溶液中氢离子浓度0.1mol•L-1,c(OH-)=$\frac{{K}_{w}}{C({H}^{+})}$,氢氧根离子浓度为1×10-12mol•L-1;
解答 解:A.在中性溶液中,氢离子浓度等于氢氧根离子浓度,故AG=lg1=0,故A正确;
B.由于酸性溶液中,氢离子浓度大于氢氧根离子浓度,氢离子浓度比氢氧根离子的比值大于1,AG>0,故B错误;
C.在0.1mol•L-1氢氧化钠溶液中氢氧根离子浓度为0.1mol•L-1,氢离子浓度为c(H+)=$\frac{{K}_{w}}{C(O{H}^{-})}$=1×10-13mol•L-1,AG=lg $\frac{1{0}^{-13}}{0.1}$=-12,故C错误;
D.0.1mol•L-1盐酸溶液中氢离子浓度0.1mol•L-1,氢氧根离子浓度为c(OH-)=$\frac{{K}_{w}}{C({H}^{+})}$=1×10-13mol•L-1,AG=lg$\frac{0.1}{1{0}^{-13}}$=12,故D正确;
故选AD.
点评 本题考查了溶液酸度的计算,正确理解酸度的概念是解本题关键,利用知识迁移的方法进行分析解答,题目难度中等.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
12.某一化学反应中,其产物的总能量为80kJ,如果该反应是放热反应,那么反应物的总能量可能是( )
| A. | 100KJ | B. | 60KJ | C. | 50KJ | D. | 30KJ |
9.某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )
| A. | 分子中的C、H、O的个数比为1:2:3 | B. | 该有机物的相对分子质量为14 | ||
| C. | 该分子中肯定不含氧元素 | D. | 分子中C、H个数比为1:2 |
16.甲乙两种溶液,已知甲溶液的pH是乙溶液pH的2倍,则甲溶液的c(H+)与乙溶液的c(H+)关系是( )
| A. | $\frac{1}{2}$倍 | B. | $\frac{1}{100}$倍 | C. | 100倍 | D. | 无法确定 |
6.以一个丁基(-C4H9)取代菲分子(如图)中的一个氢原子,所得的同分异构体数目为( )
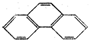

| A. | 4 | B. | 5 | C. | 9 | D. | 20 |
10.下列实验能获得成功的是( )
| A. | 苯与浓溴水用铁作催化剂制溴苯 | B. | 将苯与浓硝酸混合加热制硝基苯 | ||
| C. | 加入水后分液可除去溴苯中的溴 | D. | 可用分液漏斗分离硝基苯和水 |
11.某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生,为探究该反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理的是( )
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
| A. | A | B. | B | C. | C | D. | D |