题目内容
5.将一定浓度的碘酸钾溶液和亚硫酸氢钠溶液混合,发生反应:2KIO3+6NaHSO3═2KI+3Na2SO4+3H2SO4.实验发现:开始反应缓慢,随后反应速率“急增”,最后又逐渐减小.下列有关化学反应速率“急增”的解释合理的是( )| A. | c(IO3-)、c(HSO3-)逐渐增大 | B. | c(K+)逐渐增大,反应速率加快 | ||
| C. | 溶液的pH减小,IO3-的氧化性增强 | D. | c(H+)增大,反应速率加快 |
分析 由方程式可知,反应生成硫酸,酸性增强,IO3-的氧化性增强,可导致反应速率增大,以此解答该题.
解答 解:由信息可知,开始时HSO3-被氧化成H+和SO42-,溶液酸性增强,NaIO3氧化性增强,反应速率加快,而反应中c(IO3-)、c(HSO3-)逐渐减小,c(K+)不变,肯定不是速率增大的影响因素.
故选C.
点评 本题考查反应速率的影响因素,为高频考点,侧重于分析与应用能力的考查,题目难度不大,注意结合习题中的信息把握酸性及浓度的变化为解答该类题目的关键.

练习册系列答案
相关题目
15.开发和合理利用核能是人类解决能源危机的一个重要途径.原子核在一定条件下发生裂变(fission)或聚变(fusion)能释放出大量的能量,这就是核能.下面是一个自发进行的核裂变过程:${\;}_{98}^{252}$Cf-→${\;}_{56}^{142}$Ba+${\;}_{42}^{106}$Mo+4${\;}_{0}^{1}$n.下列有关说法正确的是( )
| A. | 核裂变或聚变中化学能转变为核能 | B. | 该核裂变中质子数守恒 | ||
| C. | Ba是人工核反应制得的超铀元素 | D. | ${\;}_{42}^{106}$Mo中含有106个中子 |
16.甲乙两种溶液,已知甲溶液的pH是乙溶液pH的2倍,则甲溶液的c(H+)与乙溶液的c(H+)关系是( )
| A. | $\frac{1}{2}$倍 | B. | $\frac{1}{100}$倍 | C. | 100倍 | D. | 无法确定 |
20.下列说法中正确的是( )
| A. | 2-甲基丁烷与正丁烷的一氯取代产物的种类相同 | |
| B. | 分子式为C4H8O2且含 基团的同分异构体共有4种 基团的同分异构体共有4种 | |
| C. | 与CH2═CHCH3与HCl发生加成反应可得到2种有机物 | |
| D. | 分子式C8H10的苯的同系物共有3种结构 |
10.下列实验能获得成功的是( )
| A. | 苯与浓溴水用铁作催化剂制溴苯 | B. | 将苯与浓硝酸混合加热制硝基苯 | ||
| C. | 加入水后分液可除去溴苯中的溴 | D. | 可用分液漏斗分离硝基苯和水 |
14.下列图示的说明或判断正确的是( )
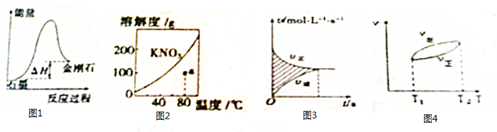

| A. | 由图1可知,从能量角度考虑,金刚石比石墨更稳定 | |
| B. | 图2中a点降温后加入KNO3 固体都能转变成饱和溶液 | |
| C. | 图3中阴影部分的面积表示△v=v正-v逆 | |
| D. | 由图4可知,正反应△H>0 |
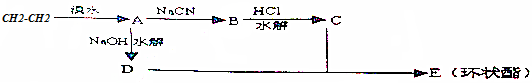
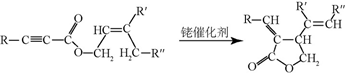
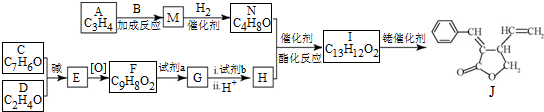

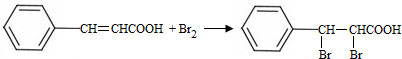 ;试剂b是NaOH、醇溶液.
;试剂b是NaOH、醇溶液.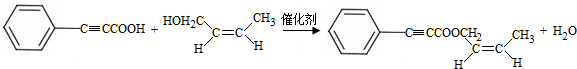 .
.