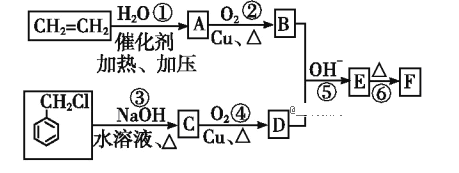
题目内容
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1 mol/L,某同学进行了如下实验,下列说法正确的是

A.原溶液中存在NH4+、Fe2+、Cl-、SO42-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.无法确定原试液中是否含有Al3+、Cl-
【答案】A
【解析】
加入过量稀硫酸无明显变化,说明无CO32-、AlO2-;加入硝酸钡有气体,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;加入NaOH有气体,说明存在铵根离子,气体氨气,沉淀B为红褐色氢氧化铁沉淀;通入少量二氧化碳产生沉淀,先与氢氧根、Ba2+反应,沉淀C为碳酸钡,不能说明存在Al3+,因为存在的离子浓度均为0.1 molL-1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl-、SO42-才能保证电荷守恒,K+不能存在。
A选项,据以上分析知道,溶液含有NH4+、Fe2+、Cl-、SO42-,故A正确;
B选项,加入硝酸钡有气体,说明有亚铁离子存在且被氧化成三价铁,则滤液X中含有的阳离子中有Fe3+,无Fe2+,故B错误;
C选项,C的成分是碳酸钡,故C错误;
D选项,溶液中一定含有氯离子,故D错误。
综上所述,答案为A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)