题目内容
【题目】下列溶液中有关物质的量浓度关系不正确的是( )
A.25℃时,0.1molL-1Na2CO3溶液中水电离出来的c(OH-)大于0.1molL-1NaOH溶液中水电离出来的c(OH-)
B.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.3molL-1 NaCl溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 molL-1
C.室温下,0.1molL-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(H2A)>c(A2-)
D.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa)
【答案】C
【解析】
A. 酸或碱抑制水的电离,含有若离子的盐促进水的电离;
B. 根据溶度积常数计算c(Ag+);
C. 室温下,0.1mol/LNaHA溶液的pH=4,说明HA-的电离程度大于水解程度;
D. pH相等的三种物质,NaOH的碱性最强,浓度最小,CH3COONa和NaHCO3中酸根离子水解程度越大,其浓度越小。
A. 酸或碱抑制水的电离,含有若离子的盐促进水的电离,所以25℃时,0.1mol/L Na2CO3溶液中水电离出来的c(OH-)大于0.1mol/L NaOH溶液中水电离出来的c(OH-),A项正确,不符合题意;
B. c(Ag+)=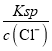 =
=![]() =6.0×10-10mol/L,B项正确,不符合题意;
=6.0×10-10mol/L,B项正确,不符合题意;
C. 室温下,0.1mol/LNaHA溶液的pH=4,说明HA-的电离程度大于水解程度,水电离生成H+,因此溶液中离子浓度大小顺序是c(HA-)>c(H+)> c(A2-) > c(H2A),C项错误,符合题意;
D. pH相等的三种物质,NaOH的碱性最强,浓度最小,水解程度CH3COO-<HCO3-,酸根离子水解程度越大,其浓度越小,所以这三种物质浓度大小顺序为c(NaOH)<c(NaHCO3)<c(CH3COONa),D项正确,不符合题意;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%