题目内容
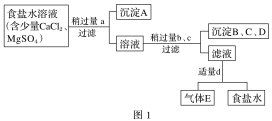
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。

(1)步骤1的主要操作是__________,需用到的玻璃仪器除烧杯、玻璃棒外有________。
(2)步骤2中发生反应的化学方程式为___________________________
(3)步骤3中发生反应的化学方程式为___________________________
(4)步骤4中涉及的操作是:蒸发浓缩、_________、过滤、洗涤、烘干。
【答案】过滤普通漏斗(或漏斗)CuSO4+Fe=FeSO4+CuFe+H2SO4=FeSO4+H2↑冷却结晶或结晶
【解析】
(1)根据框图可知,步骤1应为过滤,过滤时需要的玻璃仪器是:烧杯、漏斗、玻璃棒,故答案为:普通漏斗(或漏斗);
(2)步骤2中加入过量的铁与硫酸铜反应生成铜和氯化亚铁,发生反应的化学方程式为CuSO4+Fe=FeSO4+Cu;
(3)步骤3中加入稀硫酸将固体混合物中的铁溶解,发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;
(4)步骤4中涉及的操作是:蒸发浓缩、冷却结晶或结晶、过滤、洗涤、烘干。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目