��Ŀ����
����Ŀ���״�����Ҫ�Ļ���ԭ�ϼ���Դ���ʡ�
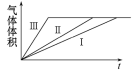
(1)����CO2��H2�ڴ����������ºϳɼ״�����������Ҫ��Ӧ����:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����H2=-58 kJ��mol-1����ij�¶�ʱ����1. 0 mol CO ��2. 0 mol H2����2 L�Ŀո�ƿ�У�����������Ӧ���ڵ�5 min ʱ�ﵽ��ѧƽ��״̬����ʱ�״������ʵ�������Ϊ10%���״�Ũ�ȵı仯״����ͼ��ʾ:
CH3OH(g)+H2O(g)����H2=-58 kJ��mol-1����ij�¶�ʱ����1. 0 mol CO ��2. 0 mol H2����2 L�Ŀո�ƿ�У�����������Ӧ���ڵ�5 min ʱ�ﵽ��ѧƽ��״̬����ʱ�״������ʵ�������Ϊ10%���״�Ũ�ȵı仯״����ͼ��ʾ:
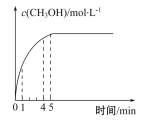
�ٴӷ�Ӧ��ʼ��5 min ʱ�����ɼ״���ƽ������Ϊ________��5 min ʱ����ʼʱ������ѹǿ��Ϊ______��
��5 min ʱ�ﵽƽ�⣬H2��ƽ��ת���ʦ�=______%����ѧƽ�ⳣ��K=______��
��1 min ʱ��v(��)(CH3OH)________4 minʱv(��)(CH3OH ) (����ڡ���С�ڡ����ڡ�)��
��������ƿ����ͬ�ݻ��ľ��ȸ�ƿ���ظ�����ʵ�飬ƽ��ʱ�״������ʵ�������________10%(�>����<����=��)��
(2)��ͼ�Ǽ״�ȼ�ϵ�ع�����ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��
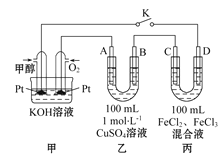
�ټ��и����ĵ缫��ӦʽΪ______________________��
������A�������������ڱ�״���µ����Ϊ________��
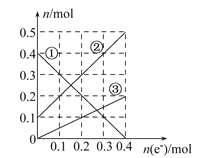
�۱�װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ����ͼ����ͼ�Т��߱�ʾ����____�ı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������Ҫ____ mL 5. 0 mol��L-1 NaOH��Һ��
���𰸡�0.025 mol��L-1��min-1 5:6 25 0.59 ���� < CH3OH-6e-+8OH-=CO32��+6H2O 2.24 L Fe2+ 280
��������
��1��������Ŀ���ݼ������£�
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ��0.5 1 0
��Ӧ��x 2x x
ƽ�⣺0.5-x 1-2xx
�״������ʵ�������Ϊ10%������x/(0.5-x+1-2x+x)��100%=10%��x=0.125mol/L��
�ٴӷ�Ӧ��ʼ��5 min ʱ�����ɼ״���ƽ������Ϊ0.125/5=0.025mol/(L��min)��ѹǿ֮�Ⱥ���������ʵ��������ȣ���ˣ�5 min ʱ����ʼʱ������ѹǿ��Ϊ����0.5-0.125+1-2��0.125+0.125����2����1+2��=5:6 ���������������������5:6��
��5 min ʱ�ﵽƽ�⣬H2��ƽ��ת���ʦ�=2��0.125/1��100%=25%����ƽ��ʱCO��H2��CH3OH�����ʵ���Ũ�ȷֱ�Ϊ��0.375mol/L��0.75mol/L��0.125mol/L������ƽ�ⳣ��K��0.125/0.375��0.752��0.59������������������ǣ�25��0.59��
����Ӧ��ƽ�������ͼ������ͼ��
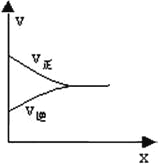
���ԣ��ڴ�ƽ��ǰ����������Ӧ���ʴ����������淴Ӧ���ʣ���1minʱ��v��(CH3OH)��4minʱv��(CH3OH )������������������ǣ����ڡ�
��������ƿ����ͬ�ݻ��ľ��ȸ�ƿ���ظ�����ʵ�飬��Ӧ�ų�����������ɢ������ʹ��ϵ�¶�����������Ӧ���ȣ��¶����ߣ�ƽ�������ƶ����״������������С������С��0.1������������������ǣ�<��
(2)�ټ״�ȼ�ϵ����ԭ��ط�Ӧ���״��ڸ���ʧ���ӷ���������Ӧ���缫��ӦΪ��CH3OH-6e-+8OH-=CO32��+6H2O���������������������CH3OH-6e-+8OH-=CO32��+6H2O��
������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ����������������������������ʵ���Ϊx����Һ��ͭ�������ʵ���Ϊ0.1mol�����������缫��ӦΪ����Cu2++2e���TCu��0.1mol Cu2+�μӷ�Ӧת�Ƶ���0.2 mol����2H++2e-=H2������������Ϊx mol����ת�Ƶ���2x mol��A�缫Ϊ��������Һ�е�����������ʧ���������������缫��ӦΪ��4OH--4e��= O2��+2H2O����������Ϊx mol��ת�Ƶ���Ϊ4x mol�����ݵ��ӵ�ʧ�غ���ɣ�0.2+2x=4x��x=0.1mol������A���������������������ʵ���Ϊ0.1mol���ڱ�״���µ����Ϊ2.24L���������������������2.24L��
������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ͭ���Ӵ������࣬���������ʵ�����С�������������ӣ���ΪFe3+����ΪFe2+����ΪCu2+�����ݢڿ�֪��������ת��Ϊ0.2molʱ�����������缫��ӦCu-2e-![]() Cu2+������Cu2+���ʵ���Ϊ0.1mol�������缫��ӦFe3++e-
Cu2+������Cu2+���ʵ���Ϊ0.1mol�������缫��ӦFe3++e-![]() Fe2+����Һ����Fe3+Ϊ0.2mol������Fe2+Ϊ0.2mol������ͼ���֪����Һ�й���Fe2+Ϊ0.3mol�����Ը�����Һ�У�Cu2+Ϊ0.1mol��Fe2+Ϊ0.3mol��Fe3+Ϊ0.2mol��֪����Ҫ����NaOH����Ϊ1.4mol������NaOH��Һ�����Ϊ:1.4 mol��5.0 moL/L =0.28L=280mL������������������ǣ�Fe2+��280��
Fe2+����Һ����Fe3+Ϊ0.2mol������Fe2+Ϊ0.2mol������ͼ���֪����Һ�й���Fe2+Ϊ0.3mol�����Ը�����Һ�У�Cu2+Ϊ0.1mol��Fe2+Ϊ0.3mol��Fe3+Ϊ0.2mol��֪����Ҫ����NaOH����Ϊ1.4mol������NaOH��Һ�����Ϊ:1.4 mol��5.0 moL/L =0.28L=280mL������������������ǣ�Fe2+��280��

����Ŀ��Ϊ��̽�����������п��ϡ���ᷴӦ���ʵ�Ӱ�죬������·���:
��� | ��п�� | 0. 2 mol��L-1������Һ | �¶� | ����ͭ���� |
�� | 2. 0 g | 200. 0 mL | 25 �� | 0 |
�� | 2. 0 g | 200. 0 mL | 35 �� | 0 |
�� | 2. 0 g | 200. 0 mL | 35 �� | 0. 2 g |
������������ȷ����
A. ��͢�ʵ��̽���¶ȶԷ�Ӧ���ʵ�Ӱ��
B. ��͢�ʵ��̽��ԭ��ضԷ�Ӧ���ʵ�Ӱ��
C. ��Ӧ���ʢ�>��>��
D. ʵ�������������ı仯ͼ����ͼ