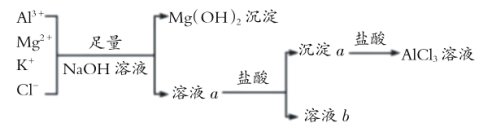
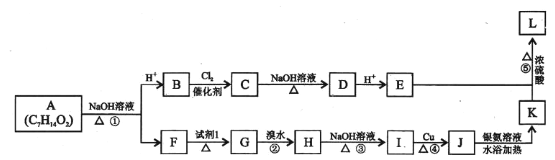
题目内容
【题目】NH3可用于制氮肥![]() 尿素、碳铵等
尿素、碳铵等![]() 、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
(1)传统的联氨(N2H4)合成方法是用NaClO溶液氧化NH3得到,反应的化学方程式为________________。联氨的电子式为________________。
(2)已知①N2(g)+3H2(g)2NH3(g) H=-92.4kJ/mol,②N2H4(l)+O2(g)N2(g)+2H2O(l) H=-624kJ/mol,则反应2NH3(g) +2H2O(l)N2H4(l)+O2(g) +3H2(g)的H=________,该反应的平衡常数表达式为________________,在常温下该反应________(填“能”或“不能”)自发进行。为了提高N2H4的产率,下列措施可行的是____________________。
A.增加H2O(l)的量B.增大压强C.降低温度 D.及时导出O2
(3)现在采用电解法合成氨,在电解法合成氨的过程中,用石墨作电极,阳极通入________________,阴极通入________________,阴极的电极反应式为________________。
【答案】NaClO+2NH3=NaCl+N2H4+H2O ![]() +716.4kJ/mol
+716.4kJ/mol 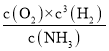 不能 D H2 N2 N2+6H++6e-=2NH3
不能 D H2 N2 N2+6H++6e-=2NH3
【解析】
(1)NaClO氧化NH3得到N2H4,N元素化合价由-3升为-2,Cl元素化合价由+1降为-1,根据得失电子守恒写出反应的化学方程式为NaClO+2NH3=NaCl+N2H4+H2O,联氨的电子式为![]() ;
;
(2)根据盖斯定律计算;平衡常数表达式K=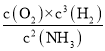 ;根据综合判据判断反应方向;
;根据综合判据判断反应方向;
A.在常温下,氨气和水反应生成氨水,增加H2O(l)的量,平衡不移动,N2H4的产率不变;
B.反应体系中,反应物气体的计量数小于生成物气体计量数的和,则增大压强平衡逆向移动,N2H4的产率降低;
C.该反应为吸热反应,降低温度,平衡逆向移动,N2H4的产率降低;
D.及时导出O2,平衡向正反应方向移动,N2H4的产率升高;
(3)电解法合成氨,阳极发生氧化反应,应通入氢气,阴极发生还原反应,应通入氮气。
(1)NaClO氧化NH3得到N2H4,N元素化合价由-3升为-2,Cl元素化合价由+1降为-1,根据得失电子守恒写出反应的化学方程式为NaClO+2NH3=NaCl+N2H4+H2O,联氨的电子式为![]() ;
;
(2)已知①N2(g)+3H2(g)2NH3(g) H=-92.4kJ/mol,②N2H4(l)+O2(g)N2(g)+2H2O(l) H=-624kJ/mol,2NH3(g) +2H2O(l)N2H4(l)+O2(g) +3H2(g) ③,根据盖斯定律③=-(①+②) H=92.4+624=+716.4 kJ/mol;
平衡常数表达式K=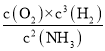 ;
;
该反应为熵增的吸热反应,H>0,S>0,则在常温下,H-TS>0,反应不能自发进行;
A.在常温下,氨气和水反应生成氨水,增加H2O(l)的量,平衡不移动,N2H4的产率不变,A错误;
B.反应体系中,反应物气体的计量数小于生成物气体计量数的和,则增大压强平衡逆向移动,N2H4的产率降低,B错误;
C.该反应为吸热反应,降低温度,平衡逆向移动,N2H4的产率降低,C错误;
D.及时导出O2,平衡向正反应方向移动,N2H4的产率升高,D正确;
答案为D;
(3)电解法合成氨,阳极发生氧化反应,应通入氢气,阴极发生还原反应,应通入氮气,阴极的电极反应方程式为N2+6H++6e-=2NH3。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍。
A | ||
B | C |
(1)A、B、C的元素名称分别为A______、B______、C_____。
(2)A的原子结构示意图为________。
(3)B在元素周期表中的位置是_______,B最高价氧化物的化学式为______。
(4)A的简单氢化物分子式为_______;B、C的最高价氧化物水化物的分子式分别为____、____。