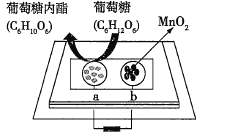
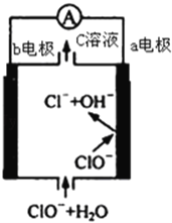
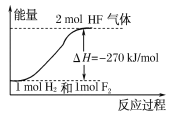
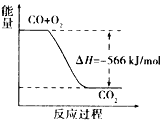
��Ŀ����
����Ŀ����Դ���������Ϊ��Լ������ᾭ�÷�չ��ƿ����Խ��Խ��Ĺ��ҿ�ʼʵ��������ƻ���������̫������Դ��Ѱ�÷�չ���¶�����
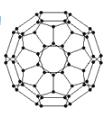
�Ÿ���ϩ���������ھ������õĹ�����ܣ���̫���ܵ�ص�Ӧ���Ͼ��зdz�������ǰ;������ϩ��C60���Ľṹ��ͼ��ʾ��������̼ԭ�ӹ�����ӻ�����Ϊ___��1 mol C60��������������ĿΪ____����
�ƶ�Ԫ�����ﱡĤ̫���ܵ�ز���Ϊ���Σ�����Ҫ�����黯�أ�GaAs�������ӣ�CdS����Ĥ��صȡ�
��һ������:As____Se������>����<������=������������____________��
������������NF3����һ����ɫ����ζ�����Ҳ���ȼ�����壬��̫���ܵ�������еõ��㷺Ӧ�á���֪NF3��NH3�Ŀռ乹�Ͷ��������Σ�NH3����Cu2+�γ������ӣ���NF3������Cu2+�γ������ӣ���ԭ����___________________��
���𰸡�sp2 90NA �� Asԭ��4p�������Ϊ��������ȶ��ṹ��Seԭ��4p�����4�����ӣ��ṹ���ȶ������Se��As��ʧȥһ��p���ӣ���һ�����ܣ�As��Se F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ������NF3������Cu2+�γ�������
��������
�Ÿ���ϩ�Ľṹ��һ����![]() ������ÿ��̼�ļۼ���
������ÿ��̼�ļۼ���
��ͬ���ڴ����ҵ�һ�����ܳ���������ƣ�����VA����ڵ�VIA�塣
�Ǹ��ݵ縺�ԶԵ��ӶԵ�������������
�Ÿ���ϩ�Ľṹ��һ����![]() ��ÿ��̼ԭ��������̼ԭ���γ�̼̼����������һ��̼ԭ���γ�̼̼˫������˷�����̼ԭ�Ӽ۲���Ӷ���Ϊ3+0 =3��̼ԭ�ӵ��ӻ�����Ϊ��sp2�ӻ������ݽṹÿ��̼ԭ����1��̼̼������0.5��̼̼˫�������1 mol C60��������60mol̼̼������30mol̼̼˫�������1mol C60��������������ĿΪ90NA����
��ÿ��̼ԭ��������̼ԭ���γ�̼̼����������һ��̼ԭ���γ�̼̼˫������˷�����̼ԭ�Ӽ۲���Ӷ���Ϊ3+0 =3��̼ԭ�ӵ��ӻ�����Ϊ��sp2�ӻ������ݽṹÿ��̼ԭ����1��̼̼������0.5��̼̼˫�������1 mol C60��������60mol̼̼������30mol̼̼˫�������1mol C60��������������ĿΪ90NA����
��ͬ���ڴ����ҵ�һ�����ܳ���������ƣ�����VA����ڵ�VIA�壬��˵�һ�����ܣ�As ��Se��������Asԭ��4p�������Ϊ��������ȶ��ṹ��Seԭ��4p�����4�����ӣ��ṹ���ȶ������Se��As��ʧȥһ��p���ӣ���һ�����ܣ�As��Se���ʴ�Ϊ��Asԭ��4p�������Ϊ��������ȶ��ṹ��Seԭ��4p�����4�����ӣ��ṹ���ȶ������Se��As��ʧȥһ��p���ӣ���һ�����ܣ�As��Se��
��NF3��NH3�Ŀռ乹�Ͷ��������Σ�NH3����Cu2+�γ������ӣ���NF3������Cu2+�γ������ӣ���ԭ����F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ������NF3������Cu2+�γ������ӣ��ʴ�Ϊ��F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ������NF3������Cu2+�γ������ӡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�