ћвƒњƒЏ»Ё
°Њћвƒњ°њЌ≠ «÷Ў“™љр ф£ђCuµƒїѓЇѕќп‘Џњ∆—І—–ЊњЇЌє§“µ…ъ≤ъ÷–Њя”––нґа”√ЌЊ£ђ»з![]() »№“Ї≥£”√„чµзљв“Ї°Ґµзґ∆“Їµ»£Ѓ«лїЎір“‘ѕ¬ќ ћв£Ї
»№“Ї≥£”√„чµзљв“Ї°Ґµзґ∆“Їµ»£Ѓ«лїЎір“‘ѕ¬ќ ћв£Ї
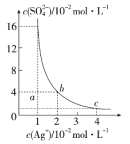
![]() —«Ќ≠јл„”
—«Ќ≠јл„”![]() їщћђ ±µƒЇЋЌвµз„”≈≈≤Љ љќ™ ______
їщћђ ±µƒЇЋЌвµз„”≈≈≤Љ љќ™ ______
![]() ЊІћеµƒґ—їэЈљ љ « ______ £ђ∆д≈дќї эќ™ ______ £ї
ЊІћеµƒґ—їэЈљ љ « ______ £ђ∆д≈дќї эќ™ ______ £ї
![]() ЌщЅтЋбЌ≠»№“Ї÷–Љ”»лєэЅњ∞±ЋЃ£ђњ……ъ≥…
ЌщЅтЋбЌ≠»№“Ї÷–Љ”»лєэЅњ∞±ЋЃ£ђњ……ъ≥…![]() £ђѕ¬Ѕ–ЋµЈ®’э»Јµƒ « ______
£ђѕ¬Ѕ–ЋµЈ®’э»Јµƒ « ______
A.![]() ÷–ЋщЇђµƒїѓ—ІЉь”–јл„”Љь°ҐЉЂ–‘ЉьЇЌ≈дќїЉь
÷–ЋщЇђµƒїѓ—ІЉь”–јл„”Љь°ҐЉЂ–‘ЉьЇЌ≈дќїЉь
B.‘Џ![]() ÷–
÷–![]() Єш≥цє¬µз„”ґ‘£ђ
Єш≥цє¬µз„”ґ‘£ђ![]() ћбє©њ’ємµј
ћбє©њ’ємµј
C.![]() „й≥…‘™ЋЎ÷–µЏ“їµзјлƒ№„оіуµƒ «—х‘™ЋЎ
„й≥…‘™ЋЎ÷–µЏ“їµзјлƒ№„оіуµƒ «—х‘™ЋЎ
D.![]() ”л
”л![]() ї•ќ™µ»µз„”ће£ђњ’Љдєє–ЌЊщќ™’эЋƒ√жће
ї•ќ™µ»µз„”ће£ђњ’Љдєє–ЌЊщќ™’эЋƒ√жће
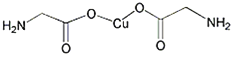
![]() ∞±їщ““ЋбЌ≠µƒЈ÷„”љбєє»зЌЉ£ђћЉ‘≠„”µƒ‘”їѓЈљ љќ™______°£Є√Ј÷„”÷–
∞±їщ““ЋбЌ≠µƒЈ÷„”љбєє»зЌЉ£ђћЉ‘≠„”µƒ‘”їѓЈљ љќ™______°£Є√Ј÷„”÷–![]() Љь”л
Љь”л![]() ЉьЄц э±»÷µќ™ ______
ЉьЄц э±»÷µќ™ ______
![]() ‘ЏєиЋб—ќ÷–£ђ
‘ЏєиЋб—ќ÷–£ђ![]() Ћƒ√жће
Ћƒ√жће![]() »зЌЉ
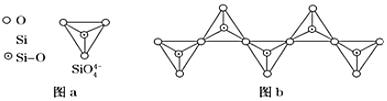
»зЌЉ![]() Ќ®єэє≤”√ґ•љ«—хјл„”њ…–ќ≥…µЇ„і°ҐЅі„і°Ґ≤г„і°Ґє«Љ№Ќш„іЋƒіујаљбєє–Ќ љ°£ЌЉbќ™“ї÷÷ќёѕё≥§µ•ЅіљбєєµƒґаєиЋбЄщ£ђSi”лOµƒ‘≠„” э÷Ѓ±»ќ™ ______ £ђїѓ—І љќ™ ______ °£
Ќ®єэє≤”√ґ•љ«—хјл„”њ…–ќ≥…µЇ„і°ҐЅі„і°Ґ≤г„і°Ґє«Љ№Ќш„іЋƒіујаљбєє–Ќ љ°£ЌЉbќ™“ї÷÷ќёѕё≥§µ•ЅіљбєєµƒґаєиЋбЄщ£ђSi”лOµƒ‘≠„” э÷Ѓ±»ќ™ ______ £ђїѓ—І љќ™ ______ °£
°Њір∞Є°њ![]() їт
їт![]() √ж–ƒЅҐЈљ„о√№ґ—їэ
√ж–ƒЅҐЈљ„о√№ґ—їэ![]() їт
їт![]() 12 AD
12 AD ![]() °Ґ
°Ґ![]() 9£Ї1 1£Ї3
9£Ї1 1£Ї3 ![]() їт
їт![]()
°Њљвќц°њ
(1)°ҐCu‘≠„” І»•4sƒ№Љґ1Єцµз„”–ќ≥…—«Ќ≠јл„”£ї
(2)°ҐCuЊІћеµƒґ—їэЈљ љ «√ж–ƒЅҐЈљ„о√№ґ—їэ£ђ≈дќї эќ™12£ї
(3)°ҐЌщЅтЋбЌ≠»№“Ї÷–Љ”»лєэЅњ∞±ЋЃ£ђњ……ъ≥…[Cu (NH3) 4]SO4, ќ™≈дЇѕќп£ђ∆д÷–Cu2+ћбє©њ’ємµј£ђNH3ћбє©є¬µз„”ґ‘£ї
(4)°ҐЄщЊЁћЉ‘≠„”µƒ≥…Љь«йњц“™“‘≈–ґѕћЉ‘≠„”µƒ‘”їѓЈљ љ£їЈ÷„”÷–Їђ”–2Єц¶–Љь£ђ∆дЋьќ™¶“Љь£ї
(5)°Ґ![]() ÷–Љџ≤гµз„”ґ‘Єц э «4«“≤їЇђє¬µз„”ґ‘£ђјы”√ЊщћѓЈ®Љ∆Ћг∆д‘≠„”Єц э±»£ђі”ґш»Јґ®∆дїѓ—І љ°£
÷–Љџ≤гµз„”ґ‘Єц э «4«“≤їЇђє¬µз„”ґ‘£ђјы”√ЊщћѓЈ®Љ∆Ћг∆д‘≠„”Єц э±»£ђі”ґш»Јґ®∆дїѓ—І љ°£
![]() ‘≠„” І»•4sƒ№Љґ1Єцµз„”–ќ≥…—«Ќ≠јл„”£ђїщћђ ±—«Ќ≠јл„”ЇЋЌвµз„”≈≈≤Љ љќ™ќ™£Ї
‘≠„” І»•4sƒ№Љґ1Єцµз„”–ќ≥…—«Ќ≠јл„”£ђїщћђ ±—«Ќ≠јл„”ЇЋЌвµз„”≈≈≤Љ љќ™ќ™£Ї![]() їт
їт![]() £ђ
£ђ
є ір∞Єќ™£Ї![]() їт
їт![]() £ї
£ї
![]() ЊІћеµƒґ—їэЈљ љ «√ж–ƒЅҐЈљ„о√№ґ—їэ£ђ‘Џљр фЊІћеµƒ„о√№ґ—їэ÷–£ђґ‘”Џ√њЄц‘≠„”јіЋµ£ђ‘Џ∆д÷№ќІµƒ‘≠„””–”л÷ЃЌђ“ї≤г…ѕ”–ЅщЄц‘≠„”ЇЌ…ѕ“ї≤гµƒ»эЄцЉ∞ѕ¬“ї≤гµƒ»эЄц£ђє √њЄц‘≠„”÷№ќІґЉ”–12Єц‘≠„””л÷ЃѕаЅђ£ђ
ЊІћеµƒґ—їэЈљ љ «√ж–ƒЅҐЈљ„о√№ґ—їэ£ђ‘Џљр фЊІћеµƒ„о√№ґ—їэ÷–£ђґ‘”Џ√њЄц‘≠„”јіЋµ£ђ‘Џ∆д÷№ќІµƒ‘≠„””–”л÷ЃЌђ“ї≤г…ѕ”–ЅщЄц‘≠„”ЇЌ…ѕ“ї≤гµƒ»эЄцЉ∞ѕ¬“ї≤гµƒ»эЄц£ђє √њЄц‘≠„”÷№ќІґЉ”–12Єц‘≠„””л÷ЃѕаЅђ£ђ
є ір∞Єќ™£Ї√ж–ƒЅҐЈљ„о√№ґ—їэ![]() їт
їт![]() £ї12£ї
£ї12£ї
![]() ќ™јл„”їѓЇѕќп£ђЇђ”–јл„”Љь£ђіж‘Џ
ќ™јл„”їѓЇѕќп£ђЇђ”–јл„”Љь£ђіж‘Џ![]() ЉЂ–‘Љь“‘Љ∞
ЉЂ–‘Љь“‘Љ∞![]() ≈дќїЉь£ђє A’э»Ј£ї
≈дќїЉь£ђє A’э»Ј£ї
B.‘Џ![]() ÷–
÷–![]() ћбє©њ’ємµј£ђ
ћбє©њ’ємµј£ђ![]() ћбє©є¬µз„”ґ‘£ђє Bінќу£ї
ћбє©є¬µз„”ґ‘£ђє Bінќу£ї
C.![]() „й≥…‘™ЋЎ÷–µЏ“їµзјлƒ№„оіуµƒ «N‘™ЋЎ£ђ„оЌв≤гќ™∞л≥д¬ъ„іћђ£ђє Cінќу£ї
„й≥…‘™ЋЎ÷–µЏ“їµзјлƒ№„оіуµƒ «N‘™ЋЎ£ђ„оЌв≤гќ™∞л≥д¬ъ„іћђ£ђє Cінќу£ї
D.![]() ”л
”л![]() ї•ќ™µ»µз„”ће£ђљбєєѕаЋ∆£ђ÷––ƒ‘≠„”–ќ≥…4Єц
ї•ќ™µ»µз„”ће£ђљбєєѕаЋ∆£ђ÷––ƒ‘≠„”–ќ≥…4Єц![]() Љь£ђњ’Љдєє–ЌЊщќ™’эЋƒ√жће£ђє D’э»Ј£Ѓ
Љь£ђњ’Љдєє–ЌЊщќ™’эЋƒ√жће£ђє D’э»Ј£Ѓ
є ір∞Єќ™£ЇAD£ї
![]() ∞±їщ““ЋбЌ≠µƒЈ÷„”÷–іж‘Џ
∞±їщ““ЋбЌ≠µƒЈ÷„”÷–іж‘Џ![]() Љь£ђћЉµƒ‘”їѓЈљ љќ™
Љь£ђћЉµƒ‘”їѓЈљ љќ™![]() ‘”їѓ£ђЇђ”–±•ЇЌћЉ‘≠„”£ђћЉµƒ‘”їѓЈљ љќ™
‘”їѓ£ђЇђ”–±•ЇЌћЉ‘≠„”£ђћЉµƒ‘”їѓЈљ љќ™![]() ‘”їѓ£їЈ÷„”÷–Їђ”–4Єц
‘”їѓ£їЈ÷„”÷–Їђ”–4Єц![]() Љь°Ґ4Єц
Љь°Ґ4Єц![]() Љь£ђ2Єц
Љь£ђ2Єц![]() Љь°Ґ2Єц
Љь°Ґ2Єц![]() Љь°Ґ2Єц
Љь°Ґ2Єц![]() Љь£ђ2Єц
Љь£ђ2Єц![]() Љь£ђ“‘Љ∞2Єц
Љь£ђ“‘Љ∞2Єц![]() Љь£ђ‘тє≤Їђ”–18Єц
Љь£ђ‘тє≤Їђ”–18Єц![]() Љь£ђ2Єц
Љь£ђ2Єц![]() Љь£ђЄ√Ј÷„”÷–
Љь£ђЄ√Ј÷„”÷–![]() Љь”л
Љь”л![]() ЉьЄц э±»÷µќ™9£Ї1£ђ
ЉьЄц э±»÷µќ™9£Ї1£ђ
є ір∞Єќ™£Ї![]() °Ґ
°Ґ![]() £ї9£Ї1£ї
£ї9£Ї1£ї
![]() ЄщЊЁЌЉ∆ђ÷™£ђ√њЄц»эљ«„ґљбєє÷–Si‘≠„” «1Єц£ђO‘≠„”Єц э
ЄщЊЁЌЉ∆ђ÷™£ђ√њЄц»эљ«„ґљбєє÷–Si‘≠„” «1Єц£ђO‘≠„”Єц э![]() £ђЋщ“‘єи‘≠„”ЇЌ—х‘≠„”Єц э÷Ѓ±»
£ђЋщ“‘єи‘≠„”ЇЌ—х‘≠„”Єц э÷Ѓ±»![]() £Ї3£ђ3ЄцO‘≠„”іш6Єцµ•ќїЄЇµзЇ…£ђ√њЄцєи‘≠„”іш4Єцµ•ќї’эµзЇ…£ђЋщ“‘–ќ≥…јл„”ќ™
£Ї3£ђ3ЄцO‘≠„”іш6Єцµ•ќїЄЇµзЇ…£ђ√њЄцєи‘≠„”іш4Єцµ•ќї’эµзЇ…£ђЋщ“‘–ќ≥…јл„”ќ™![]()
![]() їт
їт![]() £ђє ір∞Єќ™£Ї1£Ї3£ї
£ђє ір∞Єќ™£Ї1£Ї3£ї![]() їт
їт![]()

 ‘ƒґЅњм≥µѕµЅ–ір∞Є
‘ƒґЅњм≥µѕµЅ–ір∞Є°Њћвƒњ°њ“їґ®ќ¬ґ»ѕ¬£ђ‘Џ3Єц»ЁїэЊщќ™![]() µƒЇг»Ё√№±’»Ё∆ч÷–Јі”¶
µƒЇг»Ё√№±’»Ё∆ч÷–Јі”¶![]() іпµљ∆љЇв£ђѕ¬Ѕ–ЋµЈ®’э»Јµƒ «
іпµљ∆љЇв£ђѕ¬Ѕ–ЋµЈ®’э»Јµƒ «
»Ё∆ч | ќ¬ґ» | ќп÷ µƒ∆р Љ≈®ґ» | ќп÷ µƒ∆љЇв≈®ґ» | ||
|
|
|
| ||
Ґс | 400 |
|
| 0 |
|
Ґт | 400 |
|
| 0 |
|
Ґу | 500 |
|
| 0 |
|
A. Є√Јі”¶µƒ’эЈі”¶ «ќь»»Јі”¶
B. іпµљ∆љЇв ±£ђ»Ё∆чҐс÷–Јі”¶ќп„™їѓ¬ ±»»Ё∆чҐт÷–µƒ–°
C. іпµљ∆љЇв ±£ђ»Ё∆чҐт÷–![]() –°”Џ»Ё∆чҐу÷–
–°”Џ»Ё∆чҐу÷–![]()
D. іпµљ∆љЇв ±£ђ»Ё∆чҐу÷–µƒ’эЈі”¶Ћў¬ ±»»Ё∆чҐс÷–µƒ–°