��Ŀ����
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ��ϣ�����Ȼ��ɰΪ��ʼ�����һϵ�з�Ӧ���Եõ�BF3��BN������ͼ��ʾ��
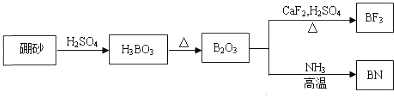
��ش��������⣺
����B2O3�Ʊ�BN�Ļ�ѧ����ʽ��_______��
�ƻ�̬Bԭ�ӵĵ����Ų�ʽΪ_____��B��N��ȣ��縺�Խϴ����_____��BN��BԪ�صĻ��ϼ�Ϊ_____��
����BF3�����У�F-B-F�ļ�����_____��Bԭ�ӵ��ӻ��������Ϊ_____��BF3����NaF���ÿ�����NaBF4��![]() �����幹��Ϊ_____��
�����幹��Ϊ_____��
�ȵ��������ж��ֽṹ�������������������������ȡ�����������ṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5pm����������������ܶ���______________g��cm-3��ֻҪ������ʽ�����ؼ������ֵ�������ӵ�����ΪNA mol��1����
���𰸡�B2O3+2NH3 ![]() 2BN+3H2O 1s22s22p1 N +3 120�� sp2 ����������
2BN+3H2O 1s22s22p1 N +3 120�� sp2 ���������� 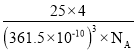
��������
��ɰ�����ᷴӦ����H3BO3��H3BO3���ȷֽ�õ�B2O3��B2O3��NH3 �ڸ����·�Ӧ����BN��H2O��B2O3�����ᡢ�����Ʒ�ӦBF3��ͬ���ڴ����ҵ縺�������������ʿռ乹�ͺ�����ԭ���ӻ���ʽʱһ���ȼ���۲���Ӷ����������ܶȹ�ʽ���м��㡣
��B2O3��NH3 �ڸ����·�Ӧ����BN��H2O���䷴Ӧ�Ļ�ѧ����ʽ��B2O3+2NH3 ![]() 2BN+3H2O���ʴ�Ϊ��B2O3+2NH3
2BN+3H2O���ʴ�Ϊ��B2O3+2NH3 ![]() 2BN+3H2O��
2BN+3H2O��
��B��5��Ԫ�أ���̬Bԭ�ӵĵ����Ų�ʽΪ1s22s22p1��ͬ���ڴ����ҵ縺�����������B��N��ȣ��縺�Խϴ����N��BN��NΪ3�ۣ�BԪ�صĻ��ϼ�Ϊ+3�ۣ��ʴ�Ϊ��1s22s22p1��N��+3��
��BF3��B�۲���Ӷ���Ϊ![]() ���ռ乹��Ϊƽ���������Σ���BF3�����У�F-B-F�ļ�����120����Bԭ�ӵ��ӻ��������Ϊsp2��BF3����NaF���ÿ�����NaBF4��BF4����B�۲���Ӷ���Ϊ
���ռ乹��Ϊƽ���������Σ���BF3�����У�F-B-F�ļ�����120����Bԭ�ӵ��ӻ��������Ϊsp2��BF3����NaF���ÿ�����NaBF4��BF4����B�۲���Ӷ���Ϊ![]() �������幹��Ϊ���������Σ��ʴ�Ϊ��120����sp2�����������Ρ�
�������幹��Ϊ���������Σ��ʴ�Ϊ��120����sp2�����������Ρ�
������������ṹ����ʯ���ƣ����ʯ����8��̼ԭ�ӣ�����������������4��BN�������߳�Ϊ361.5pm����������������ܶ���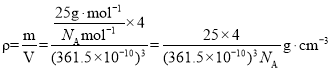 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

����Ŀ��ijͬѧΪ��̽��п�����ᷴӦ�����е����ʱ仯������100mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų����������������������Ϊ��״���µ��������ʵ���¼���£��ۼ�ֵ����
ʱ��/min | 1 | 2 | 3 | 4 | 5 |
�������/mL | 50 | 120 | 232 | 290 | 310 |
��1����Ӧ��������ʱ�����__������0��1min����1��2min����2��3min������4��5min������ԭ����__��
��2����Ӧ������С��ʱ�����__������0��1min����1��2min����2��3min������4��5min������ԭ����__��
��3��2��3minʱ����ڣ��������Ũ�ȱ仯��ʾ�÷�Ӧ������Ϊ__��
��4�������Ӧ̫���ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ���������������ͬѧ�������зֱ��������������Һ�壬����Ϊ���е���__������ţ���
A.����ˮ B.NaCl��Һ C.Na2CO3��Һ D.CuSO4��Һ