̀âÄ¿ÄÚÈƯ
¡¾̀âÄ¿¡¿»Ø´đÏÂÁĐÎỀ⣺
1Lº£Ë®ÔÚÖđ½¥Å¨Ëơ¹ư³̀ÖĐÎö³öÑεÄÖÖÀàºÍÖÊÁ¿£¨µ¥Î»£ºg£©µÄ¹ØϵÈçϱíËùʾ£º
º£Ë®ĂܶÈ(gmL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | ¡ª |
1.22 | 0.015 | 9.65 | 0.01 | 0.012 | ¡ª |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | ¡ª | 1.40 | 0.54 | 0.03 | 0.06 |
×¢£º»¡°¡ª¡±µÄÊư¾ƯÉÙÓÚ10-4£¬¿É̉ÔºöÂÔ²»¼Æ¡£
(1)´Óº£Ë®ÖĐ»ñµĂ´ÖÑΣ¬̉»°ă²ÉÓõķ½·¨ÊÇ___¡£
(2)¸ù¾ƯÉÏ±í£¬̉ª»ñµĂÔÓÖʽÏÉÙµÄʳÑΣ¬Ó¦¿ØÖƺ£Ë®µÄ×î¼ÑĂܶÈΪ___gmL-1£῭î×Öĸ£©¡£
A£®1.21 B£®1.22 C£®1.26 D£®1.31
(3)´ÖÑÎÖĐ³£º¬ÓĐMgCl2¡¢MgSO4¡¢CaCl2µÈÔÓÖÊ£¬̉ª³ưÈ¥ƠâĐ©ÔÓÖÊ£¬°´Ë³Đ̣¼ÓÈëµÄÊÔ¼Á̉À´ÎΪNaOH¡¢BaCl2¡¢___¡¢___µÈ£῭ѧʽ£©¡£
(4)¹¤̉µÉϵç½âÈÛÈÚÂÈ»¯ÄÆÖÆÈ¡½đÊôÄƵĻ¯Ñ§·½³̀ʽΪ___¡£
(5)ÄÆÔªËصÄ̉»ÖÖ³£¼ûÑơ»¯Îï¿É×÷ΪºôÎüĂæ¾ßµÄ¹©Ñơ¼Á£¬Đ´³ö¸ĂÑơ»¯ÎïºÍCO2·´Ó¦µÄ»¯Ñ§·½³̀ʽ___¡£
¡¾´đ°¸¡¿Ơô·¢»̣ÈƠɹ B Na2CO3 HCl 2NaCl(ÈÛÈÚ)![]() 2Na£«Cl2¡ü 2Na2O2+2CO2=2Na2CO3+O2
2Na£«Cl2¡ü 2Na2O2+2CO2=2Na2CO3+O2
¡¾½âÎö¡¿
(1)ÔÚº£Ë®Öđ½¥Å¨Ëơ¹ư³̀ÖĐ£¬º£Ë®ÖеÄÄ³Đ©ÑεÄŨ¶È»á·¢Éú̉»¶¨µÄ¸Ä±ä£¬±íÖĐÊưֵΪÎö³öÑεÄÖÊÁ¿£¬Ëù̉Ổª»ñȡijÖÖÑΣ¬Ó¦Ñ¡ÔñÆäÎö³öÁ¿¶àµÄµă¡£
(2)³ưÈ¥´ÖÑÎÖеÄÔÓÖÊ£¬Ä³Đ©ÊÔ¼ÁµÄ¼ÓÈë´æÔÚ̉»¶¨µÄ˳Đ̣£¬̉²¾ÍÊÇÏȼÓÈëµÄÊÔ¼Á£¬¹ưÁ¿²¿·ÖĐè̉ªºó¼ÓÈëÊÔ¼ÁÈ¥³ư¡£¶Ô´ÖÑÎ̀á´¿À´Ëµ£¬Óë´ËÏà¹ØµÄÊÔ¼ÁΪNa2CO3ºÍHCl£¬Ëù̉ÔNa2CO3±ØĐëÔÚ¼ÓÈëBaCl2Ö®ºó¼ÓÈ룬HCl±ØĐëÔÚ¹ưÂËÖ®ºó¼ÓÈë¡£
(1)´Óº£Ë®ÖĐ»ñµĂ´ÖÑΣ¬³£ĐèÔö´óŨ¶È£¬ÈĂÑÎË®±äµĂ±¥ºÍ£¬Ëù̉Ổ»°ă²ÉÓõķ½·¨ÊÇƠô·¢»̣ÈƠɹ¡£´đ°¸Îª£ºƠô·¢»̣ÈƠɹ£»
(2)¸ù¾Ư±íÖĐĐÅÏ¢£¬̉ª»ñµĂÔÓÖʽÏÉÙµÄʳÑΣ¬Ó¦¿ØÖƺ£Ë®µÄ×î¼ÑĂܶÈΪ1.22gmL£1£¬ƠâʱÎö³öʳÑÎ×î¶à£¬ÔÓÖÊ×îÉÙ£¬̣̉´ËÑ¡B¡£´đ°¸Îª£ºB£»
(3)´ÖÑÎÖĐ³£º¬ÓĐMgCl2¡¢MgSO4¡¢CaCl2µÈÔÓÖÊ£¬¼ÓNaOHÓĂÀ´³ưÈ¥Mg2+£¬¼ÓÈëBaCl2³ưÈ¥SO42-£¬Ó¦¼ÓÈëNa2CO3³ưÈ¥¹ưÁ¿µÄBa2+ºÍÔÓеÄCa2+£¬×îºó¼ÓÈëÑÎËá³ưÈ¥¹ưÁ¿µÄCO32-£¬̉ª³ưÈ¥ƠâĐ©ÔÓÖÊ£¬°´Ë³Đ̣¼ÓÈëµÄÊÔ¼Á̉À´ÎΪNaOH¡¢BaCl2¡¢Na2CO3¡¢HCl¡£´đ°¸Îª£ºNa2CO3£»HCl£»
(4)¹¤̉µÉϵç½âÈÛÈÚÂÈ»¯ÄÆÖÆÈ¡½đÊôÄÆ£¬»¯Ñ§·½³̀ʽΪ2NaCl(ÈÛÈÚ)![]() 2Na£«Cl2¡ü¡£´đ°¸Îª£º2NaCl(ÈÛÈÚ)
2Na£«Cl2¡ü¡£´đ°¸Îª£º2NaCl(ÈÛÈÚ)![]() 2Na£«Cl2¡ü£»
2Na£«Cl2¡ü£»
(5)¹ưÑơ»¯ÄÆ¿É×÷ΪºôÎüĂæ¾ßµÄ¹©Ñơ¼Á£¬ËüºÍCO2·´Ó¦µÄ»¯Ñ§·½³̀ʽ2Na2O2 + 2CO2 == 2Na2CO3 + O2¡£´đ°¸Îª£º2Na2O2 + 2CO2 == 2Na2CO3 + O2¡£

¡¾̀âÄ¿¡¿̉ÑÖªÏÂÁĐÊư¾Ư£º
ÎïÖÊ | ÈÛµă/¡æ | ·Đµă/¡æ | ĂܶÈ/ |
̉̉´¼ |
| 78.3 | 0.79 |
̉̉Ëá | 16.6 | 117.9 | 1.05 |
̉̉Ëá̉̉ơ¥ |
| 77 | 0.90 |
ijѧÉúÔÚʵÑéỂÖÆÈ¡̉̉Ëá̉̉ơ¥µÄÖ÷̉ª²½ÖèÈçÏ£º
¢ÙÅäÖÆ![]() ŨẠ́Ëá¡¢
ŨẠ́Ëá¡¢![]() ̉̉´¼£¨º¬
̉̉´¼£¨º¬![]() £©ºÍ
£©ºÍ![]() ̉̉ËáµÄ»́ºÏÈÜ̉º¡£
̉̉ËáµÄ»́ºÏÈÜ̉º¡£
¢Ú°´ÈçͼÁ¬½ÓºĂ×°ÖĂ£¨×°ÖĂÆøĂÜĐÔÁ¼ºĂ£©²¢¼ÓÈë»́ºÏ̉º£¬ÓĂĐ¡»đ¾ùÔȼÓÈÈ![]() ¡£
¡£
¢Û´ưÊÔ¹Ü̉̉ÊƠ¼¯µ½̉»¶¨Á¿²úÎïºóÍ£Ö¹¼ÓÈÈ£¬³·³öÊÔ¹Ü̉̉²¢ÓĂÁ¦Ơñµ´£¬È»ºó¾²ÖĂ´ư·Ö²ă¡£
¢Ü·ÖÀë³ö̉̉Ëá̉̉ơ¥£¬Ï´µÓ¡¢¸ÉÔï¡£
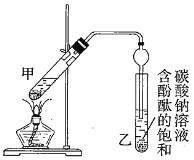
(1)ÅäÖÆ¢ÙÖĐ»́ºÏÈÜ̉ºµÄ·½·¨Îª_______________________________£»·´Ó¦ÖĐŨẠ́ËáµÄ×÷ÓĂÊÇ____________________________£»Đ´³öÖÆÈ¡̉̉Ëá̉̉ơ¥µÄ·´Ó¦µÄ»¯Ñ§·½³̀ʽ£º____________________________£¨±ê³ö![]() £©¡£
£©¡£
(2)ÉÏÊöʵÑéÖб¥ºÍ̀¼ËáÄÆÈÜ̉ºµÄ×÷ÓĂÊÇ________£῭î×Öĸ£©¡£
A.ÖĐºÍ̉̉ËáºÍ̉̉´¼ B.ÖĐºÍ̉̉Ëá²¢ÎüÊỞ̉´¼
C.¼ơÉÙ̉̉Ëá̉̉ơ¥µÄÈܽâ D.¼ÓËÙơ¥µÄÉú³É£¬̀á¸ßÆä²úÂÊ
(3)²½Öè¢ÚÖĐĐè̉ªĐ¡»đ¾ùÔȼÓÈÈ£¬ÆäÖ÷̉ªỘ̉ÊÇ____________________________£»²½Öè¢ÛËù¹Û²́µ½µÄÏÖÏóÊÇ_______________________________________£»Óû½«̉̉ÊÔ¹ÜÖеÄÎïÖÊ·ÖÀë̉Եõ½̉̉Ëá̉̉ơ¥£¬±ØĐëʹÓõÄ̉ÇÆ÷ÓĐ___________£»·ÖÀëʱ£¬̉̉Ëá̉̉ơ¥Ó¦´Ó̉ÇÆ÷_____________£῭î¡°Ï¿ڷš±»̣¡°ÉÏ¿Úµ¹¡±£©³ö¡£
(4)¸Ăͬѧ·´¸´ÊµÑ飬µĂ³ö̉̉´¼Óë̉̉ËáµÄÓĂÁ¿ºÍµĂµ½µÄ̉̉Ëá̉̉ơ¥Éú³ÉÁ¿ÈçÏÂ±í£º
ʵÑé | ̉̉´¼/ | ̉̉Ëá/ | ̉̉Ëá̉̉ơ¥/ |
¢Ù | 2 | 2 | 1.33 |
¢Ú | 3 | 2 | 1.57 |
¢Û | 4 | 2 | x |
¢Ü | 5 | 2 | 1.76 |
¢Ư | 2 | 3 | 1.55 |
±íÖĐÊư¾ƯxµÄ·¶Î§ÊÇ__________________£»ÊµÑé¢Ù¢Ú¢Ừ½¾¿µÄÊÇ_____________________¡£
¡¾̀âÄ¿¡¿̉»¶¨Î¶ÈÏ£¬ÔÚÈư¸ö̀å»ư¾ùΪ2.0 LµÄºăÈƯĂܱƠÈƯÆ÷ÖĐ·¢Éú·´Ó¦£ºPCl5(g)![]() PCl3(g)+Cl2(g)¡£
PCl3(g)+Cl2(g)¡£
±àºÅ | ÎÂ¶È /¡æ | ÆđʼÎïÖÊ µÄÁ¿/mol | ƽºâÎïÖÊ µÄÁ¿/mol | ´ïµ½Æ½ºâ ËùĐèʱ¼ä/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
¢ñ | 320 | 0.40 | 0.10 | 0.10 | t |
¢̣ | 320 | 0.80 | t1 | ||
¢ó | 410 | 0.40 | 0.15 | 0.15 | t2 |
ÏÂÁĐ˵·¨ƠưÈ·µÄÊÇ
A.ƽºâ³£ÊưK£ºÈƯÆ÷¢̣>ÈƯÆ÷¢ó
B.·´Ó¦µ½´ïƽºâʱ£¬PCl5µÄת»¯ÂÊ£ºÈƯÆ÷¢̣>ÈƯÆ÷¢ñ
C.·´Ó¦µ½´ïƽºâʱ£¬ÈƯÆ÷¢ñÖеÄƽ¾ùËÙÂÊΪv(PCl5)=![]() mol¡¤L-1¡¤s-1
mol¡¤L-1¡¤s-1
D.ÆđʼʱỊ̈ÈƯÆ÷¢óÖĐ³äÈëPCl5 0.30 mol¡¢PCl3 0.45 molºÍCl2 0.10 mol£¬Ộ·´Ó¦½«Ị̈Äæ·´Ó¦·½Ị̈½øĐĐ