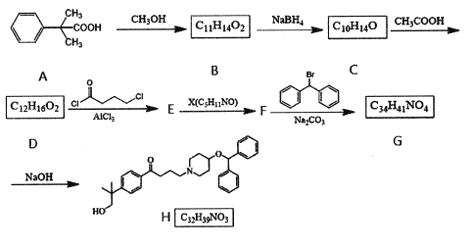
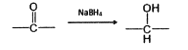
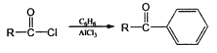
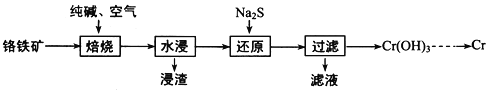
题目内容
【题目】已知反应:①Cl2+2KBr=2KCl+Br2;②KClO3+6HCl=3Cl2↑+KCl+3H2O;③2KBrO3+Cl2=Br2+2KClO3。下列说法正确的是:( )
A.①中KCl 是氧化产物,KBr发生还原反应
B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C.反应②中氧化剂与还原剂的物质的量之比为1:6
D.③中1 mol氧化剂参加反应得到电子的物质的量为2.5 mol
【答案】B
【解析】
A. ①中Cl2是氧化剂,KCl 是还原产物,KBr是还原剂,发生氧化反应,A错误;
B. ①Cl2+2KBr=2KCl+Br2中氧化剂是Cl2,氧化产物是Br2,则氧化性:Cl2>Br2,②KClO3+6HCl=3Cl2+KCl+3H2O中氧化剂是KClO3,氧化产物是Cl2,则氧化性:KClO3>Cl2,③2KBrO3+Cl2=Br2+2KClO3中氧化剂是KBrO3,氧化产物是KClO3,所以氧化性:KBrO3>KClO3,故物质氧化性由强到弱顺序是KBrO3>KClO3>Cl2>Br2,B正确;
C. 在②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂是KClO3,还原剂是HCl,参加反应的HCl中有![]() 作还原剂,所以氧化剂与还原剂的物质的量之比为1:
作还原剂,所以氧化剂与还原剂的物质的量之比为1:![]() ×6=1:5,C错误;
×6=1:5,C错误;
D. ③KBrO3是氧化剂,Br元素化合价由反应前+5价变为反应后Br2的0价,化合价降低5价,所以1 mol氧化剂参加反应得到电子的物质的量为5 mol,D错误;
故合理选项是B。

【题目】回答下列问题:
1L海水在逐渐浓缩过程中析出盐的种类和质量(单位:g)的关系如下表所示:
海水密度(gmL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | — |
1.22 | 0.015 | 9.65 | 0.01 | 0.012 | — |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | — | 1.40 | 0.54 | 0.03 | 0.06 |
注:画“—”的数据少于10-4,可以忽略不计。
(1)从海水中获得粗盐,一般采用的方法是___。
(2)根据上表,要获得杂质较少的食盐,应控制海水的最佳密度为___gmL-1(填字母)。
A.1.21 B.1.22 C.1.26 D.1.31
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,要除去这些杂质,按顺序加入的试剂依次为NaOH、BaCl2、___、___等(填化学式)。
(4)工业上电解熔融氯化钠制取金属钠的化学方程式为___。
(5)钠元素的一种常见氧化物可作为呼吸面具的供氧剂,写出该氧化物和CO2反应的化学方程式___。
【题目】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ/mol)依次为 578、1 817、2 745、11 575、14 830、18 376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
请用化学用语填空:
(1)请写出Q元素基态原子的外围电子排布图:_______。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序是__________(用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是__________。
(4)写出Z元素的原子核外电子排布式_________。
(5)Q元素原子的未成对电子个数是________ 个。