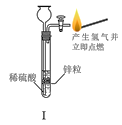
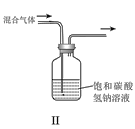
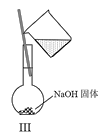
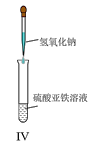
题目内容
【题目】铁的许多化合物在生产、生活中有着广泛的应用,如FeCl3是重要的金属蚀刻剂、水处理剂;影视作品拍摄中常用Fe(SCN)3溶液模拟血液;FeS可用于消除水中重金属污染等。
(1)已知:①3Cl2(g)+2Fe(s)=2FeCl3(s) ΔH1=akJ·mol-1
②2FeCl2(s)+Cl2(g)=2FeCl3(s) ΔH2=bkJ·mol-1
则2FeCl3(s)+Fe(s)=3FeCl2(s) ΔH3=____。
(2)将c(FeCl3)=0.2mol·L-1的溶液与c(KSCN)=0.5mol·L-1的溶液按等体积混合于某密闭容器发生反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
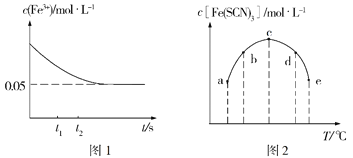
①研究表明,上述反应达到平衡后,向体系中加入适量KCl固体后,溶液颜色无变化,其原因是___,根据图1分析,在t1、t2时刻,生成Fe3+的速率较大的是____时刻。
②常温下Fe3++3SCN-![]() Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
③根据图2判断,该反应的ΔH___0(填“>”或“<”),图中五个点对应的状态中,一定处于非平衡态的是___(填对应字母)。
(3)利用FeS可除去废水中的重金属离子,如用FeS将Pb2+转化为PbS可消除Pb2+造成的污染,当转化达到平衡状态时,废水中c(Fe2+)=___c(Pb2+)[填具体数据,已知Ksp(PbS)=8×10-28,Ksp(FeS)=6×10-18]。
【答案】(0.5a-1.5b)kJ·mol-1 反应的本质是Fe3++3SCN-![]() Fe(SCN)3,KCl的加入对可逆反应状态不造成影响 t2 1000 < < a、b 7.5×109
Fe(SCN)3,KCl的加入对可逆反应状态不造成影响 t2 1000 < < a、b 7.5×109
【解析】
(1)根据盖斯定律![]() ,可得热化学方程式;
,可得热化学方程式;
(2)①判断KCl固体对可逆反应![]() 的影响,t2时生成物浓度比t1时大,逆反应速率较大,故生成Fe3+速率较大;
的影响,t2时生成物浓度比t1时大,逆反应速率较大,故生成Fe3+速率较大;
②![]() 平衡常数
平衡常数![]() 以此计算;溶液稀释后Q>K平衡向左移动,v(正)<v(逆);
以此计算;溶液稀释后Q>K平衡向左移动,v(正)<v(逆);
③随着温度的升高反应速率加快,故a、b、c c[Fe(SCN)3]增大,随着温度升高t1时已达到平衡点,温度升高c[Fe(SCN)3]减小,则平衡逆移;
(3)由![]() 知,
知,![]() ,以此分析。
,以此分析。
(1)已知:①3Cl2(g)+2Fe(s)=2FeCl3(s) ΔH1=akJ·mol-1
②2FeCl2(s)+Cl2(g)=2FeCl3(s) ΔH2=bkJ·mol-1
根据盖斯定律![]() 可得
可得![]() ΔH3=(0.5a-1.5b)kJ·mol-1,故答案为:(0.5a-1.5b)kJ·mol-1;
ΔH3=(0.5a-1.5b)kJ·mol-1,故答案为:(0.5a-1.5b)kJ·mol-1;
(2)①由于反应的本质是![]() ,因此KCl的加入对可逆反应状态不造成影响;t2时生成物浓度比t1时大,逆反应速率较大,故生成Fe3+速率较大,故答案为:反应的本质是Fe3++3SCN-
,因此KCl的加入对可逆反应状态不造成影响;t2时生成物浓度比t1时大,逆反应速率较大,故生成Fe3+速率较大,故答案为:反应的本质是Fe3++3SCN-![]() Fe(SCN)3,KCl的加入对可逆反应状态不造成影响;t2;
Fe(SCN)3,KCl的加入对可逆反应状态不造成影响;t2;
②由图Ⅰ知,达到平衡时c(Fe3+)=0.05 mol·L-1,故反应中消耗Fe3+的浓度为0.1 mol·L-1-0.05 mol·L-1=0.05 mol·L-1,平衡时c[Fe(SCN)3]=0.05 mol·L-1,c(SCN-)=0.25 mol·L-1-0.15 mol·L-1=0.1 mol·L-1,则平衡常数![]() ;溶液稀释后
;溶液稀释后![]() >K平衡向左移动,v(正)<v(逆),故答案为:1000;<;
>K平衡向左移动,v(正)<v(逆),故答案为:1000;<;
③随着温度的升高反应速率加快,故a、b、c三点c[Fe(SCN)3]增大,随着温度升高c时已达到平衡点,温度升高c[Fe(SCN)3]减小,则平衡逆移,则反应ΔH<0,图中五个点对应的状态中,处于非平衡态的是a、b,故答案为:<;a、b;
(3)由![]() 可知,
可知,![]() ,故
,故![]() ,故答案为:7.5×109。
,故答案为:7.5×109。

 名校课堂系列答案
名校课堂系列答案【题目】回答下列问题:
1L海水在逐渐浓缩过程中析出盐的种类和质量(单位:g)的关系如下表所示:
海水密度(gmL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | — |
1.22 | 0.015 | 9.65 | 0.01 | 0.012 | — |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | — | 1.40 | 0.54 | 0.03 | 0.06 |
注:画“—”的数据少于10-4,可以忽略不计。
(1)从海水中获得粗盐,一般采用的方法是___。
(2)根据上表,要获得杂质较少的食盐,应控制海水的最佳密度为___gmL-1(填字母)。
A.1.21 B.1.22 C.1.26 D.1.31
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,要除去这些杂质,按顺序加入的试剂依次为NaOH、BaCl2、___、___等(填化学式)。
(4)工业上电解熔融氯化钠制取金属钠的化学方程式为___。
(5)钠元素的一种常见氧化物可作为呼吸面具的供氧剂,写出该氧化物和CO2反应的化学方程式___。
【题目】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ/mol)依次为 578、1 817、2 745、11 575、14 830、18 376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
请用化学用语填空:
(1)请写出Q元素基态原子的外围电子排布图:_______。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序是__________(用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是__________。
(4)写出Z元素的原子核外电子排布式_________。
(5)Q元素原子的未成对电子个数是________ 个。