题目内容
18.对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:Qc=Cp(C)•Cq(D)/Cm(A)•Cn(B),叫该反应的浓度商.(1)化学平衡常数只与温度有关,与反应物或生成物的浓度无关.
(2)Qc<K,反应向正反应方向进行
Qc=K,反应处于平衡状态
Qc>K,反应向逆反应方向进行
(3)若升高温度,K值增大,则正反应为吸热反应(填“吸热”或“放热”).
若升高温度,K值减小,则正反应为放热反应(填“吸热”或“放热”).
(4)写出下面可逆反应Fe(s)+CO(g)?Fe(s)+CO2(g)的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$
(5)若N2(g)+3H2(g)?2NH3(g)的平衡常数为K1,
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)的平衡常数为K2,
NH3(g)?$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)的平衡常数为K3;
写出K1和K2的关系式:K1=K22.
写出K2和K3的关系式:K2•K3=1.
写出K1和K3的关系式:K1•K32=1.
分析 (1)化学平衡常数是温度的函数,所以只与温度有关,与反应物或生成物的浓度无关;
(2)Qc<K,反应向正反应方向移动;Qc=K,反应处于平衡状态,平衡不移动;Qc>K,反应向逆反应移动;
(3)若升高温度,K值增大,说明平衡正向移动,所以正反应为是吸热反应;若升高温度,K值减小,说明平衡逆向移动,所以正反应为是放热反应;
(4)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意当反应中有固体物质参加时,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度,稀溶液中的水分子浓度可不写;
(5)同一可逆反应(化学计量数相同),在相同温度下,化学平衡常数互为倒数,同一反应若化学计量数变为原来的n倍,平衡常数变为原来的n次幂,据此解答.
解答 解:(1)化学平衡常数是温度的函数,所以只与温度有关,与反应物或生成物的浓度无关,故答案为:温度;
(2)Qc<K,反应向正反应方向移动;Qc=K,反应处于平衡状态,平衡不移动;Qc>K,反应向逆反应移动,故答案为:正反应方向;逆反应方向;
(3)若升高温度,K值增大,说明平衡正向移动,所以正反应为是吸热反应;若升高温度,K值减小,说明平衡逆向移动,所以正反应为是放热反应,故答案为:吸热;放热;
(4)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意当反应中有固体物质参加时,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度,稀溶液中的水分子浓度可不写,所以平衡常数为:K=$\frac{c(C{O}_{2})}{c(CO)}$,故答案为:$\frac{c(C{O}_{2})}{c(CO)}$;
(5)同一可逆反应(化学计量数相同),在相同温度下,化学平衡常数互为倒数,同一反应若化学计量数变为原来的n倍,平衡常数变为原来的n次幂,所以K1=K22(或 K1=1/K22),K2•K3=1(或 K2=1/K3),K1•K32=1(或 K2=1/K32),故答案为:K1=K22;K2•K3=1;K1•K32=1.
点评 本题考查了化学平衡常数,以及同一反应正逆反应平衡常数关系、及平衡常数与化学计量的关系,难度不大,注意对平衡时表达式的理解.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A. | Zn与稀H2SO4反应:Zn+H+═Zn2++H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | MgCl2溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
H3BO3的转化率(α)在不同温度下随反应时间(t)的变化如右图,由此图可以得出:该反应的△H( )
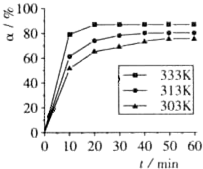
| A. | △H<0 | B. | △H>0 | C. | △H=0 | D. | 无法判断 |
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 0.1 L 3 mo1•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
| A. | 容器内压强 | B. | 平均相对分子质量 | ||
| C. | 各组分浓度 | D. | 混合气体的颜色 |
①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑
②Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl
关于上述反应的分析不正确的是( )
| A. | ①、③是置换反应,②是化合反应 | |
| B. | 高温下,焦炭与氢气的还原性均弱于硅 | |
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 | |
| D. | 在第三个反应中,SiCl4作氧化剂 |
| A. | PH3 sp2 平面三角形 | B. | SO32- sp2 平面三角形 | ||
| C. | SO2 sp2 V形 | D. | NO3- sp3 三角锥形 |
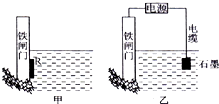 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是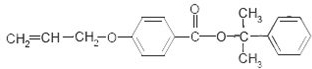 .
.