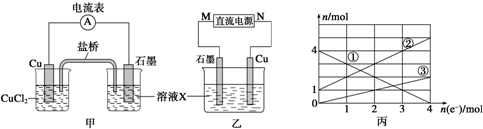
题目内容
6. 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式.负极:Fe-2e-=Fe2+;正极:O2+2H2O+4e-=4OH-.
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用如图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用锌.(请写出具体金属名称)
(3)如图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源的负极.
分析 (1)钢铁发生吸氧腐蚀,负极上Fe失电子发生氧化反应,正极上氧气得电子发生还原反应;
(2)作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
(3)作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护.
解答 解:(1)钢铁发生吸氧腐蚀,负极上Fe失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:Fe-2e-=Fe2+;O2+2H2O+4e-=4OH-;
(2)作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,根据图知,该装置是利用原电池原理保护Fe,所以应该选取比Fe活泼的金属,如锌,
故答案为:锌;
(3)作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护,根据图知,该装置是利用电解池原理保护Fe,则铁作电解池阴极,应该连接电源负极,故答案为:负.
点评 本题考查金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,可以采用物理或化学方法保护金属,防止金属被腐蚀,减少浪费.

练习册系列答案
相关题目
16.将一定量的有机物A溶于烧碱溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液红色变浅,再向其中加入盐酸,显酸性,并析出白色晶体;取少量上述晶体放到FeCl3溶液中,溶液呈紫色.则有机物A可能是( )
| A. |  | B. |  | C. | 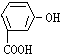 | D. |  |
17.下列氧化物中,能与水反应生成酸的是( )
| A. | SiO2 | B. | NO | C. | Al2O3 | D. | SO3 |
14.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 | |
| D. | 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |
1.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
( )
( )
| A. | 950 mL 111.2 g | B. | 500 mL 117.0 g | ||
| C. | 1000 mL 117.0 g | D. | 1000 mL 111.2 g |
15.下列离子方程式,正确的是( )
| A. | 用小苏打治疗胃酸过多:2H++CO32-═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至恰好为中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 碳酸氢钠溶液与过量的氢氧化钙溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |