题目内容
8.关于分子或离子中心原子的杂化轨道类型和空间构型,下列判断正确的是( )| A. | PH3 sp2 平面三角形 | B. | SO32- sp2 平面三角形 | ||
| C. | SO2 sp2 V形 | D. | NO3- sp3 三角锥形 |
分析 根据价层电子对互斥理论确定原子杂化和分子空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答 解:A.PH3中P原子价层电子对个数是4且含有一个孤电子对,所以P原子采用sp3杂化,但该分子为三角锥形结构,故A错误;
B.SO32-中S原子价层电子对个数是4且含有一个孤电子对,所以S原子采用sp3杂化,但该离子为三角锥形结构,故B错误;
C.三角锥形SO2中S原子价层电子对个数是3且含有一个孤电子对,所以S原子采用sp2杂化,该分子为V形结构,故C正确;
D.NO3-中N原子价层电子对个数是3且不含孤电子对,所以N原子采用sp3杂化,且该离子为平面三角形结构,故D错误;
故选C.
点评 本题考查微粒空间构型及原子杂化方式判断,为高频考点,明确价层电子对互斥理论内涵是解本题关键,难点是孤电子对计算方法,题目难度不大.

练习册系列答案
相关题目
19.电石中碳化钙可以制取乙炔气体,制取时,将反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
(1)实验室制取乙炔气体的方程式:CaC2+2H2O→C2H2↑+Ca(OH)2
(2)若用下列仪器和导管组装实验装置:
如果所制气体流向从左向右时,上述仪器和导管从上到下,从左到右直接连接的顺序(填各仪器,导管的序号)是6接3接1接5接2接4.
(3)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次)
①称取一定量电石,置于仪器3中,塞紧橡皮塞; ②检查装置的气密性 ③在仪器6和5中注入适量水; ④待仪器3恢复至室温时,量取仪器4中水的体积(导管2中水的体积忽略不计) ⑤慢慢开启仪器6的活塞,使水逐滴滴下至不发生气体时,关闭活塞.正确操作顺序是B
A.①③②⑤④B.②①③⑤④C.①③⑤④②
(4)若实验中产生的气体存在难闻的气味,且测定结果偏大,这是因为电石中含有杂质气体,可以用硫酸铜溶液或氢氧化钠溶液加以除去.
(1)实验室制取乙炔气体的方程式:CaC2+2H2O→C2H2↑+Ca(OH)2
(2)若用下列仪器和导管组装实验装置:
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  | 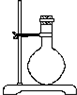 |  |  | 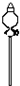 |
| 每个橡皮塞上都打了两个孔 | ||||||
(3)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次)
①称取一定量电石,置于仪器3中,塞紧橡皮塞; ②检查装置的气密性 ③在仪器6和5中注入适量水; ④待仪器3恢复至室温时,量取仪器4中水的体积(导管2中水的体积忽略不计) ⑤慢慢开启仪器6的活塞,使水逐滴滴下至不发生气体时,关闭活塞.正确操作顺序是B
A.①③②⑤④B.②①③⑤④C.①③⑤④②
(4)若实验中产生的气体存在难闻的气味,且测定结果偏大,这是因为电石中含有杂质气体,可以用硫酸铜溶液或氢氧化钠溶液加以除去.
3.下列实验装置(固定装置略去)和操作正确的是( )
| A. | 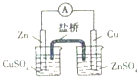 构成铜锌原电池 | B. | 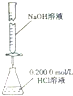 酸碱中和滴定 | C. | 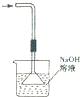 吸收HCl尾气 | D. | 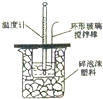 中和热的测定 |
13.下列分子中,所有原子不可能处于同一平面的是( )
| A. | CH2═CH2 | B. | CH3CH=CH2 | C. | 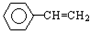 | D. | CO2 |
20.将一小块钠投入盛有5mL饱和石灰水的试管中,不可能观察到的现象是( )
| A. | 钠熔成光亮的小球,在液面四处游动 | |
| B. | 有气体产生 | |
| C. | 溶液底部有银白色的物质 | |
| D. | 溶液变浑浊 |
18.1molH2SO4的质量约是一个硫酸分子质量的( )
| A. | 6.02×1023倍 | B. | 6.02倍 | C. | 98倍 | D. | 3.01×1023倍 |