题目内容
15.含有4个原子核,10个电子的微粒是( )| A. | CH4 | B. | NH4+ | C. | H3O+ | D. | PH3 |
分析 中性微粒质子数等于电子数,离子中质子数=电子数±所带电荷数,据此解题.
解答 解:A.CH4的核外电子数为1×4+6═10,含有5个原子核,故A错误;
B.NH4+的核外电子数为1×4+7-1═10,含有5个原子核,故B错误;
C.H3O+的核外电子数为1×3+8-1═10,含有4个原子核,故C正确;
D.PH3的核外电子数为1×3+18═18,含有4个原子核,故D错误.
故选C.
点评 本题考查微粒中的质子数和电子数,难度不大,注意中性微粒质子数等于电子数,离子中质子数=电子数±所带电荷数.

练习册系列答案
相关题目
15.下列各反应的化学方程式中,属于水解反应的是( )
| A. | H2CO3+H2O?H3O++HCO3- | B. | HCO3-+H2O?OH-+H2CO3 | ||
| C. | HCO3-+OH-?H2O+CO32- | D. | HCO3-+H2O?H3O++CO32- |
3.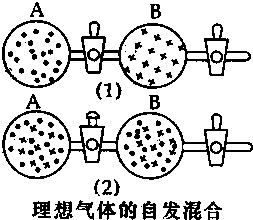 在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
 在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )| A. | 此过程是从混乱程度小的向混乱程度大变化过程,即熵增大的过程 | |
| B. | 此过程为自发过程,而且没有热量的吸收或放出 | |
| C. | 此过程从有序到无序,混乱度增大 | |
| D. | 此过程是自发可逆的 |
10.下列各项中的两个量,其比值一定为2:1的是( )
| A. | 相同温度下,0.2mol•L-1醋酸溶液与0.1mol•L-1醋酸中的c(H+ )之比 | |
| B. | 在Na2O2晶体中阳离子与阴离子的物质的量之比 | |
| C. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积之比 | |
| D. | 22.4LCO2与22.4L CO所含氧原子数目之比 |
20.将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )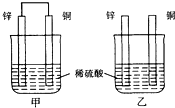

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的pH均增大 | D. | 甲、乙溶液均变蓝色 |
7.现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示).
(2)写出E溶液与过量的B溶液反应的离子方程式2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓.
(3)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(4)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或-1)浓度由大到小的顺序为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+).
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示).
(2)写出E溶液与过量的B溶液反应的离子方程式2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓.
(3)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(4)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或-1)浓度由大到小的顺序为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+).
4.萜类物质中有许都已被用于香料工业.常见的有如下几种结构(括号内表示④的结构简式):

关于上述四种香料,下列说法正确的是( )

关于上述四种香料,下列说法正确的是( )
| A. | ②和③均属于烯烃类 | B. | ①和③互为同分异构体 | ||
| C. | ④是②的氧化产物 | D. | ③和④均能发生消去、酯化反应 |
5.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{500℃30MPa}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |