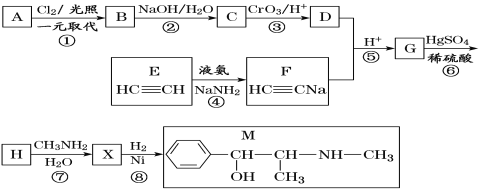
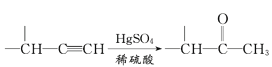
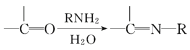
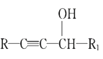题目内容
【题目】工业上用空气氧化(NH4)2SO3的方法制取(NH4)2SO4,某研究小组用如图装置模拟该过程,并通过测定反应后溶液中SOT的浓度来计算该反应的转化率。

实验步骤如下:
①按图连接好装置,检查装置气密性;
②取200 mL 0.5000 molL-1(NH4)2SO3溶液(调节pH = 8)装入三颈烧瓶中,加入催化剂,控制气体流速为300 Lh-1,在温度为50℃下进行实验;
③反应2.5 h后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器M的名称为_____,仪器M中装有H2O2溶液,则装置A中发生反应的化学方程式为_______。
(2)实验中通如N2的目的是_____。
(3)装置B的作用是_____(任答一条)。
(4)装置C中采用多孔球泡的目的是_____,已知亚硫酸铵溶液的pH小于8,要调节装置C中溶液的pH=8,应向该溶液中加入一定量的_____(填标号
a NH3 H2O b Ba(OH)2 c 澄清石灰水
(5)该实验缺少的装置是_____。
(6)取VmL反应后的溶液(反应前后体积不变)于碘量瓶中,滴入3滴淀粉溶液,用a molL-1的标准碘溶 液滴定至终点时,消耗碘水的体积为b mL,则(NH4 )2SO3的转化率为_____。
【答案】分液漏斗 2H2O2![]() 2H2↑+O2↑ 氮气与氧气混合模拟空气 观察通入的N2和O2流速以调节两者的体积比(或提供水蒸气) 增大混合物气体与亚硫酸铵的接触面积,加快反应速率 a 带有温度计的水浴加热装置
2H2↑+O2↑ 氮气与氧气混合模拟空气 观察通入的N2和O2流速以调节两者的体积比(或提供水蒸气) 增大混合物气体与亚硫酸铵的接触面积,加快反应速率 a 带有温度计的水浴加热装置 ![]()
【解析】
装置A为制备氧气的装置,其反应方程式为:2H2O2![]() 2H2↑+O2↑,与氮气一同模拟空气进入装置B中,装置B的作用是观察通入的N2和O2流速或提供水蒸气,进入装置C中,氧化亚硫酸铵,装置D中的稀硫酸的作用为尾气处理。
2H2↑+O2↑,与氮气一同模拟空气进入装置B中,装置B的作用是观察通入的N2和O2流速或提供水蒸气,进入装置C中,氧化亚硫酸铵,装置D中的稀硫酸的作用为尾气处理。
(1)仪器M的名称为分液漏斗,装置A制备氧气,根据装置可以判断反应为2H2O2![]()
2H2↑+O2↑,故答案为:分液漏斗;2H2O2![]() 2H2↑+O2↑;
2H2↑+O2↑;
(2)实验目的是模拟空气氧化亚硫酸铵,氮气与氧气混合模拟空气,故答案为:氮气与氧气混合模拟空气;
(3)装置B的作用是观察通入的N2和O2流速或提供水蒸气,避免气体带走装置C中水蒸气使溶液体积减小,导致剩余SO32-浓度偏大,最终测得(NH4)2SO3的转化率减小;故答案为:观察通入的N2和O2流速以调节两者的体积比(或提供水蒸气);
(4)采用多孔球泡可以增大混合物气体与亚硫酸铵的接触面积,加快反应速率,Ba(OH)2与澄清石灰水均与SO32-反应,影响SO32-转化率,根据装置图,用稀硫酸吸收尾气,说明调节pH用的是氨水,故答案为:增大混合物气体与亚硫酸铵的接触面积,加快反应速率;a;
(5)可以判断出该实验缺少的装置是带有温度计的水浴加热装置,故答案为:带有温度计的水浴加热装置;
(6)根据反应方程式:SO32-+I2+H2O=SO42-+2I-+2H+,计算n(SO32-)=n(I2)=ab×10-3mol,则(NH4)2SO3的转化率为![]() ,故答案为:
,故答案为:![]() 。
。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:i.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+。
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Cr3+ |
开始沉淀的pH | 1.5 | 4.9 |
沉淀完全的pH | 2.8 | 6.8 |
回答下列问题:
(1)滤渣①的主要成分为_________(填化学式)。
(2)"氧化”步骤中发生反应的离子方程式为____________。
(3)“加热"操作的目的是_________。
(4)“酸化"过程中发生的反应为2CrO42- +2H+![]() Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。
Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。
(5)可利用微生物电池将镀铬废水中的Cr2O72-催化还原,其工作原理如图所示:
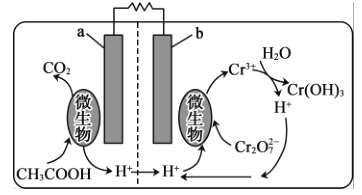
在该电池中,b作______极,a极的电极反应为__________
(6)K2 Cr2O7标准溶液还可用于测定市售硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol -1)的纯度。测定步骤如下:
i.溶液配制:称取1.2400g市售硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后.全部转移至100mL容量瓶中.加蒸馏水至刻度线。
ii.滴定:取0.01000 mol. L-1的K2Cr2 O7标准溶液20. 00 mL,稀硫酸酸化后加入过量KI溶液,发生反应(Cr2O72-被还原成Cr3+ ,I-被氧化成I2)。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32 - =S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液蓝色褪去.即为终点。平行滴定3次,样品溶液的平均用量为25.00mL。
①稀硫酸酸化的K2Cr2O7标准溶液与KI溶液反应的离子方程式为_________
②该市售硫代硫酸钠晶体样品的纯度为_______%(保留1位小数)。