题目内容
【题目】工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是 。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度下,将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
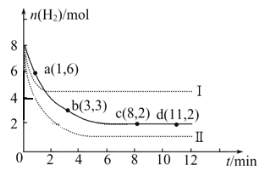
①a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”),在1~3min内的平均反应速率v(H2)= 。
②仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
(3)甲醇可用于制作燃料电池,若电解质溶液为酸性,负极的电极反应式为: 。
【答案】(1)BC;(2)①大于;0.75mol·L-1·min-1;②升温;加压;
(3)CH3OH+ H2O - 6e- = CO2↑+6H+
【解析】
试题分析:(1)n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1,之后浓度可能还在变化,故A不一定达到平衡状态;该反应为反应前后压强可变的反应,压强不变时一定达到平衡状态;H2的消耗速率与CH3OH的消耗速率之比为3∶1可知![]() ,一定达到平衡状态;根据
,一定达到平衡状态;根据![]() ,从开始反应到反应达到平衡,密度不变,密度不随时间变化不能作为平衡标志,故D错误;
,从开始反应到反应达到平衡,密度不变,密度不随时间变化不能作为平衡标志,故D错误;
(2)①a点氢气的量在减少,平衡正向进行,故正反应速率大于逆反应速率;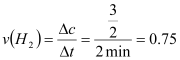 mol·L-1·min-1②曲线I反应速率明显加快,但平衡时氢气的量增大,故实验条件改变是升高温度;曲线II反应速率加快,但平衡时氢气的量减小,故实验条件改变是加压;
mol·L-1·min-1②曲线I反应速率明显加快,但平衡时氢气的量增大,故实验条件改变是升高温度;曲线II反应速率加快,但平衡时氢气的量减小,故实验条件改变是加压;
(3)负极为甲醇失电子发生氧化反应,极反应为CH3OH+ H2O - 6e- = CO2↑+6H+。

【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。